2+4=2 Єдина зброя в боротьбі з антибіотикорезистентністю
07.07.20202+4=2
Два типи антибіотикорезистентності
В ході природного відбору бактерії сформували різноманітні пристосувальні механізми. Вони об’єднані назвою – природна резистентність.
Поява протимікробних препаратів відкрила нову сторінку в історії людства – розвиток хірургії, збільшення народжуваності і тривалості життя. Для бактеріального всесвіту індустрія протимікробних препаратів відкрила новий фронт боротьби за виживання, на якому перемагають лідери розвитку набутої антибіотикорезистентності.
|
Природна антибіотикорезистентність Природна антибіотикорезистентність — відсутність у мікроорганізмів мішені для дії антибіотика або недоступності мішені внаслідок первинно низької проникності або ферментативної інактивації. Наприклад, Pseudomonas aeruginosa є природно стійкою до багатьох антибіотиків.
Набута антибіотикорезистентність — властивість окремих штамів бактерій зберігати життєздатність при тих концентраціях антибіотиків, які пригнічують основну частину мікробної популяції. Антибіотикорезистентність превалює над можливостями протимікробних препаратів, про що свідчать звіти ВОЗ, CDC та ECDC1-3. Тому ми не можемо більше розраховувати на нові препарати, а повинні навчитись працювати з антибіотикорезистентними патогенами, застосовуючи мікробіологічні методи діагностики. Сьогодні ми маємо реальну можливість ідентифікації аеробних патогенів з одночасним визначенням антибіотикочутливості і маркерів резистентності протягом 3х діб. |
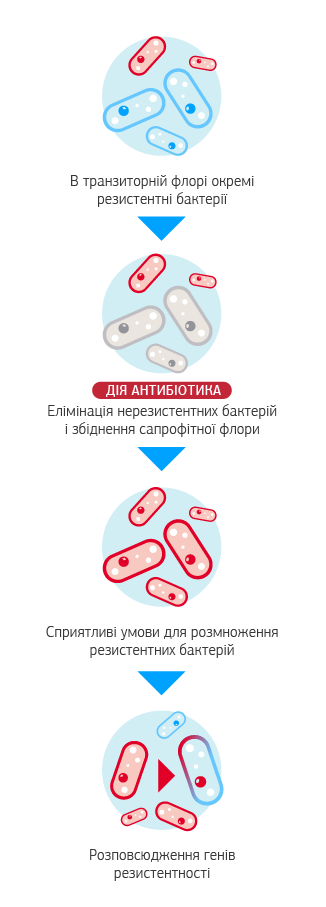 |
Коротко про розповсюдження набутої антибіотикорезистентності
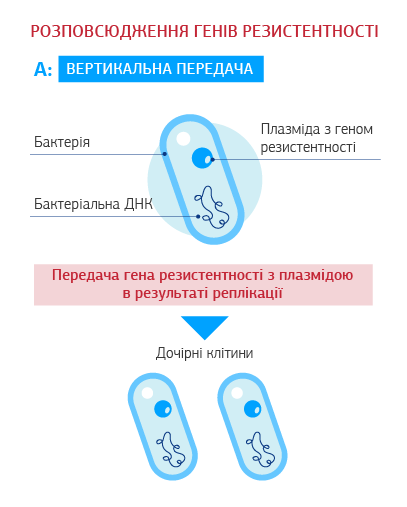
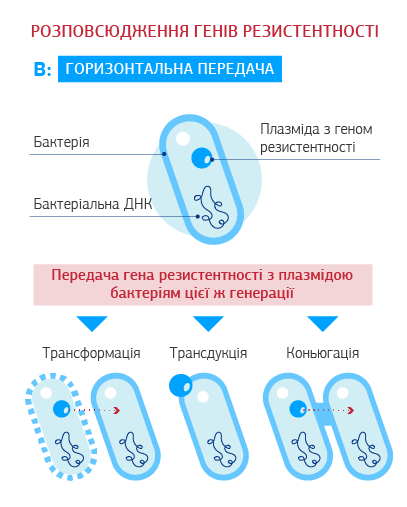
Набута резистентність виникає шляхом формування мутацій (резистентний клон) або отримання зміненого генетично матеріалу від інших бактерій свого або іншого виду (горизонтальне внутрішньо- або міжвидове розповсюдження). Гени резистентності розташовані на мобільних генетичних елементах – плазмідах (молекулах ДНК, окремих від хромосомної та здатних до автономної реплікації) або на транспозонах (мобільних ДНК-послідовностях, які можуть переміщуватись в геномі).
 |
 |
2+4=2
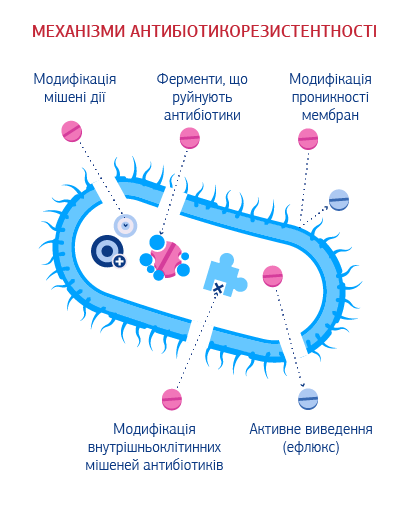
Чотири основних механізми виникнення набутої антибіотикорезистентності
|
 |
 |
Дослідження показали, що повсякчасне застосування антибіотиків розширеного спектру всліпу, просто щоб про всяк випадок перекрити можливу присутність резистентних збудників, не лише сприяє розвитку резистентності, а й погіршує результати лікування4-6. |
Маркери резистентності – нова зброя в лікуванні та обмеженні розповсюдження антибіотикорезистентних штамів
Автоматизація мікробіологічних досліджень забезпечує не лише швидку видову ідентифікацію широкого спектру збудників, а й одночасне визначення антибіотикочутливості і маркерів резистентності.
Автоматизований бакпосів від ДІЛА – це можливість визначення всіх відомих маркерів резистентності:
- бета-лактамази розширеного спектра (ESBL);
- резистентність Staphylococcus spp. та Streptococcus spp. до ма мкролідів, лінкозамідів, стрептограмінів (Efflux/MLSb);
- метицилін-резистентний Staphylococcus aureus (MRSA);
- резистентність Staphylococcus aureus, обумовелена геном mecA (mecA);
- серед Staphylococcus spp. штами, продукуючі β-лактамазу (BL);
- резистентність та проміжна резистентність Staphylococcus aureus до ванкоміцину (VRSA, VISA);
- резистентність та проміжна резистентність Staphylococcus aureus до тейкопланіну (TISA, TRSA);
- резистентність Enterococcus spp. до ванкоміцину (VRE) та тейкопланіну (TRE);
- резистентність високого рівня до аміноглікозидів (HLAR);
- резистентність високого рівня Staphylococcus aureus до мупіроцину
- продукція карбапенемаз.
2+4=2
Дві складові ефективного лікування
- антибіотикочутливість – впевненість в ефективності обраного препарату, можливість застосування антибіотиків вузького спектру, препаратів резерву;
- маркери резистентності – можливість індивідуального підбору терапевтичних комбінацій при мультирезистентних збудниках.
Наприклад, стійкість ентеробактерій до карбапенемів може бути спричинена:
- зниженням проникності мембрани та бета-лактамазами зі слабкою активністю щодо карбапенемів (маркери AmpC або CTX-M) – не мають горизонтального трансферу, вірогідність передачі резистентного клона контактній особі низька, виживаність таких бактерій знижена.
АБО
- експресією істиних карбапенемаз (маркери KPC, IMP, VIM, OXA) – закодовані в плазмідах, активний горизонтальний трансфер, асоційовані з мульти/панантибіотикорезистентністю, висока вірогідність інфікування контактних осіб.
 |
В стаціонарі та після виписки пацієнтам з антибіотикорезистентними патогенами, які продукують істині карбапенемази, надаються рекомендації для обмеження їх розповсюдження. Можливе обстеження родичів на носійство резиcтентних штамів7. |
| Резистентність до карбапенемів внаслідок непроникності мембрани | Резистентність до карбапенемів внаслідок продукції карбапенемаз |
| нема горизонтального трансферу | активний горизонтальний трансфер |
| низька виживаність | висока виживаність |
| низька вірогідність інфікування контактних осіб | висока вірогідність інфікування контактних осіб – потрібні епідеміологічні заходи |
| як правило не мультирезистентні | часто мульти- та панрезистентні |
| комбіновані панелі чутливості автоматизованого бакпосіву дозволяють обрати ефективний антибіотик | комбіновані панелі чутливості автоматизованого бакпосіву дозволяють обрати комбінацію препаратів (колістин, аміноглікозиди, тігециклін) |
Висновки:
- антибіотикорезистентність – розповсюджена проблема, актуальна для всіх;
- ефективне лікування інфекцій, викликаних антибіотикорезистентними мікроорганізмами, можливе, коли ґрунтується на аналізі даних про патоген. Це дані про чутливість до препаратів і про маркери резистентності;
- автоматизована мікробіологія від ДІЛА – видова ідентифікація широкого спектру патогенів з одночасним визначенням антибіотикочутливості та маркерів резистентності протягом 3х діб.
 |
Не пропустіть наше наступне повідомлення про сучасні принципи антибактеріальної терапії. |
Джерела:
1. https://www.who.int/news-room/detail/01-06-2020-record-number-of-countries-contribute-data-revealing-disturbing-rates-of-antimicrobial-resistance
2. https://www.cdc.gov/drugresistance/pdf/threats-report/2019-ar-threats-report-508.pdf
3. Surveillance of antimicrobial resistance in Europe 2018
4. Rhee, Chanu, et al. "Prevalence of antibiotic-resistant pathogens in culture-proven sepsis and outcomes associated with inadequate and broad-spectrum empiric antibiotic use." JAMA Network Open 3.4 (2020)
5. Falagas ME, Lourida P, Poulikakos P, Rafailidis PI, Tanarli GS. Antibiotic treatment of infections due to carbapenem-resistant Enterobacteriaceae; systematic evaluation of the available evidence. Antimicrob Agents Chemother 2014
6. Temkin E, Adler A, Lerner A, Carmeli Y. Carbapenem-resistant Enterobacteriaceae: biology, epidemiology and management. Ann NY Acad Sci USA 2014
7. Bonomo, Robert A., et al. "Carbapenemase-producing organisms: a global scourge." Clinical Infectious Diseases 66.8 (2018)
8. https://today.duke.edu/2015/01/superbug (джерело малюнка)















