Складний діагноз - анемія у дівчинки підліткового віку
23.01.2023
За даними ВООЗ, на анемію страждає близько 24% населення планети. Цей стан особливо притаманний немовлятам, дітям та підліткам, вагітним жінкам. Проте може розвиватися також в інших груп людей, незалежно від віку та статі. Причини — недостатність заліза в раціоні, прийом деяких медикаментів, генетична схильність, наявність хронічних захворювань, які протікають непомітно. Солдатова Оксана Володимирівна – к. мед. н., доцент кафедри дитячих і підліткових захворювань Національного університету охорони здоров’я України імені П.Л. Шупика, експерт ДОЗ КМДА, віце-президент Незалежної Асоціації нутріциологів та дієтологів України, поділилась складним шляхом діагностичного пошуку у дівчини-підлітки, 17 років.
Пацієнтка звернулась зі скаргами, що турбували її упродовж року, на:
- періодичний абдомінальний біль після їжі, який зменшувався після дефекації;
- здуття живота;
- слабкість, головокружіння, пронос 4-5 р. на добу переважно після їжі ( випорожнення були рідкими, світло-коричневого кольору зі слизом)
- зниження ваги за рік на 6 кг;
- 4 епізоди діареї за рік без гіпертермії та блювання, останній епізод діареї та абдоміналього болю ( у правому підреберʼї та мезогастрії) тривав 2 тижні.
Свої скарги дівчина пов’язує з психоемоційним навантаженням, зміною харчування, вживанням «тяжкої» їжі.
Згідно клінічного обстеження:
- шкіра бліда, живіт мʼякий,
- помірне здуття,
- незначна болючість при пальпацїї товстого кишківника,
- помірна болючість в т. Кєра,
- язик з незначним жовтуватим нашаруванням й помірними відбитками зубів;
- інші органи та системи без особливостей.
В анамнезі життя:
- алергія на білок коровʼячого молока, яйця, цитрусові - до 5 років;
- перенесені кишкові інфекції, лямбліоз, аскаридоз.
Спадковість необтяжена.
В загальному аналізі крові анемія (гемоглобін – 69 г/л та 63 г/л при повторному обстеженні), мікроцитоз, анізоцитоз еритроцитів, гіпохромія, нейтропенія (32.5%), моноцитоз (16.2%), лімфоцитоз (48.2%), підвищена кількість ретикулоцитів (12%; 20% при повторі). Значно знижені рівні заліза (1.5 ммоль/л) та феритину (2.5 нг/мл). В біохімії крові: підвищений рівень загального білірубіну -26.9 мкмоль/л , АЛТ- 143, АСТ -96. У копрограмі- значна кількість нейтрального жиру та йодофільних бактерій — при повторному обстеженні. За результатами УЗД черевної порожнини: збільшений жовчний міхур з крупнодисперсним вмістом.
Діагноз: Залізодефіцитна анемія середнього ступеню важкості. Функціональний біліарний розлад сфінктера Оді. Біліарний сладж.
Рекомендовано додаткове обстеження на:
- гепатит (вірусний, токсичний, криптогенний )
- гельмінтоз (аскаридоз, токсокароз)
- паразитоз (лямбліоз, амебіаз)
- запальне захворювання кишківника
- синдром подразненого кишківника
- харчову алергію або гіперчутливість до молока, яєць, сої, злаків
Пацієнтка була обстежена на вірусний гепатит А (HAV) антитіла IgM, вірус гепатиту B (HBV), HBcorAg, антитіла IgM , HBsAg , вірус гепатиту C (HCV )- Anti-HCV IgG cor, NS3 , NS4, NS5; цитомегаловірус -антитіла IgМ, вірус Епштейна-Барр – гетерофільні антитіла IgM та отримала негативні результати.
Наступним кроком проводились діагностичні тести для виявлення СПК (синдрому подразненого кишечника) та ЗЗК (запальних захворювань кишечника), ПЛР тест на Хелікобактерну інфекцію.
Отже, для того щоб відрізнити СПК (синдром подразненого кишечника) від інших кишкових розладів, лікарі повинні відзначати хронічний і рецидивуючий перебіг СПК і знати діагностичні критерії, засновані на частоті симптомів та їх тривалості. СПК є доброякісним функціональним розладом, який не пов’язаний зі збільшенням смертності і не трансформується у серйозне захворювання, однак значно знижує якість життя пацієнтів.
Згідно Римських критеріїв IV для СПК характерно:
Періодичний абдомінальний біль із частотою ≥1 епізоду на тиждень за останні 3 міс, що асоціюється з ≥2 критеріями:
- Зв'язок із актом дефекації
- Зв'язок із зміною частоти випорожнень
- Зв'язок із зміною форми (зовнішнього вигляду) випорожнень
Важливим моментом є виключення так званих клінічних симптомів тривоги, до яких належать:
- Сімейний анамнез по ЗЗК
- Постійний больовий синдром
- Гемоколіт
- Хронічна діарея (більше 3 р на день більше 2 тижнів), нічна діарея
- Лихоманка невідомого генезу
- Втрата ваги
- Артрит
- Постійна блювота
- Параректальний біль (тріщини, нориці)
- Дисфагія, одинофагія
- Гепато та/або спленомегалія
При наявності будь-якого з перерахованих симптомів можна запідозрити, органічне захворювання (кишкове або позакишкове), яке необхідно виявити.
Для пацієнтів із ЗЗК неінвазивних біомаркерів запалення – виявлення ФК ( фекального кальпротектину) та дослідження калу на приховану кров (наявність гемоглобіну і трансферину) – має високу діагностичну та прогностичну значимість. Кальпротектин виділяється у великих кількостях з калом при пошкодженні слизової оболонки кишківника, є маркером активності лейкоцитів і запалення в шлунково-кишковому тракті. Підвищений рівень кальпротектину є показом до колоноскопї та біопсії.
Дослідження калу на приховану кров (наявність гемоглобіну і трансферину) є неінвазивним маркером шлунково-кишкової кровотечі. Наявність гемоглобіну в калі людини є специфічним маркером кровотечі з нижніх відділів ШКТ, оскільки гемоглобін – нестабільна сполука, яка перетворюється при проходженні по кишківнику. Трансферин – більш стабільна сполука та використовується як маркер кровотечі і з верхніх, і з нижніх відділів ШКТ. Позитивний результат дослідження на вміст гемоглобіну та трансферину у калі свідчить про наявність кровотечі з верхніх та нижніх відділів ШКТ і значну імовірність кровотечі саме з нижніх відділів. При негативному результаті на наявність гемоглобіну та позитивному – на наявність трансферину діагностується кровотеча з верхніх відділів ШКТ, при позитивному результаті тесту на гемоглобін та негативному на трансферин – кровотеча з нижніх відділів ШКТ. Відсутність гемоглобіну та трансферину у калі означає, що кровотеча відсутня.
Використання обох тестів - визначення вмісту гемоглобіну та трансферину у калі одночасно забезпечує підвищення ефективності діагностики та зменшення виконання необґрунтованих ендоскопічних досліджень, особливо у дітей.
Результати досліджень пацієнтки:

За результатами досліджень та для покрокової діагностики захворювань:
- Виразкової хвороби шлунка/ДПК
- Атрофічного гастриту
- Еозинофільного гастриту
- Хвороби Крона
- Раку шлунку
Дівчині запропонована гастроскопія (ФГДС) з біопсією та отримана- відмова.
В подальшому, проведені окремі дослідження на гельмінтози: аскаридоз, токсокароз, аналіз калу на яйця гельмінтів – отримані негативні результати. Пацієнтка обстежена на лямбліоз: отримано позитивний результат на загальні антитіла (IgG + IgM + IgA) Giardia lamblia та антиген лямблій у калі.
Встановлений попередній діагноз: Залізодефіцитна анемія середнього ступеня важкості. Лямбліоз. Функціональний біліарний розлад сфінктера Оді. Біліарний сладж. Криптогенний гепатит.
Призначено відповідне лікування, лабораторні дослідження в динаміці.
Лікування:
- протипаразитарні (альбендазол 5 днів 15 мг/кг)
- гепатопротектори (гептрал, хофітол)
- ентеросорбенти (лактофільтрум)
- пробіотики (ентерол, лактіалє)
- ферменти (креон)
- препарати заліза (мальтофер (Fe ІІІ) 100 мг 3 р/добу 1 місяць
- сорбіфер дурулес (Fe ІІ) – 320 мг 2 р на добу) - 4 місяця
- фолієва кислота 5 мг 3 р на добу – 1 місяць, вітаміни В1, В6, В12 – 1 місяць
Після 2 місяців лікування рівень гемоглобіну у ЗАК піднявся до 78 г/л, АЛТ- 57, АСТ- 48 . В динаміці у пацієнтки: загальний стан задовільний, скарги на періодичне здуття живота, кал оформлений, регулярний, вага збільшилась, покращився стан волосся та нігтів.
Рівні заліза, феритина, насичення трансферину залізом, залишилися низькими.
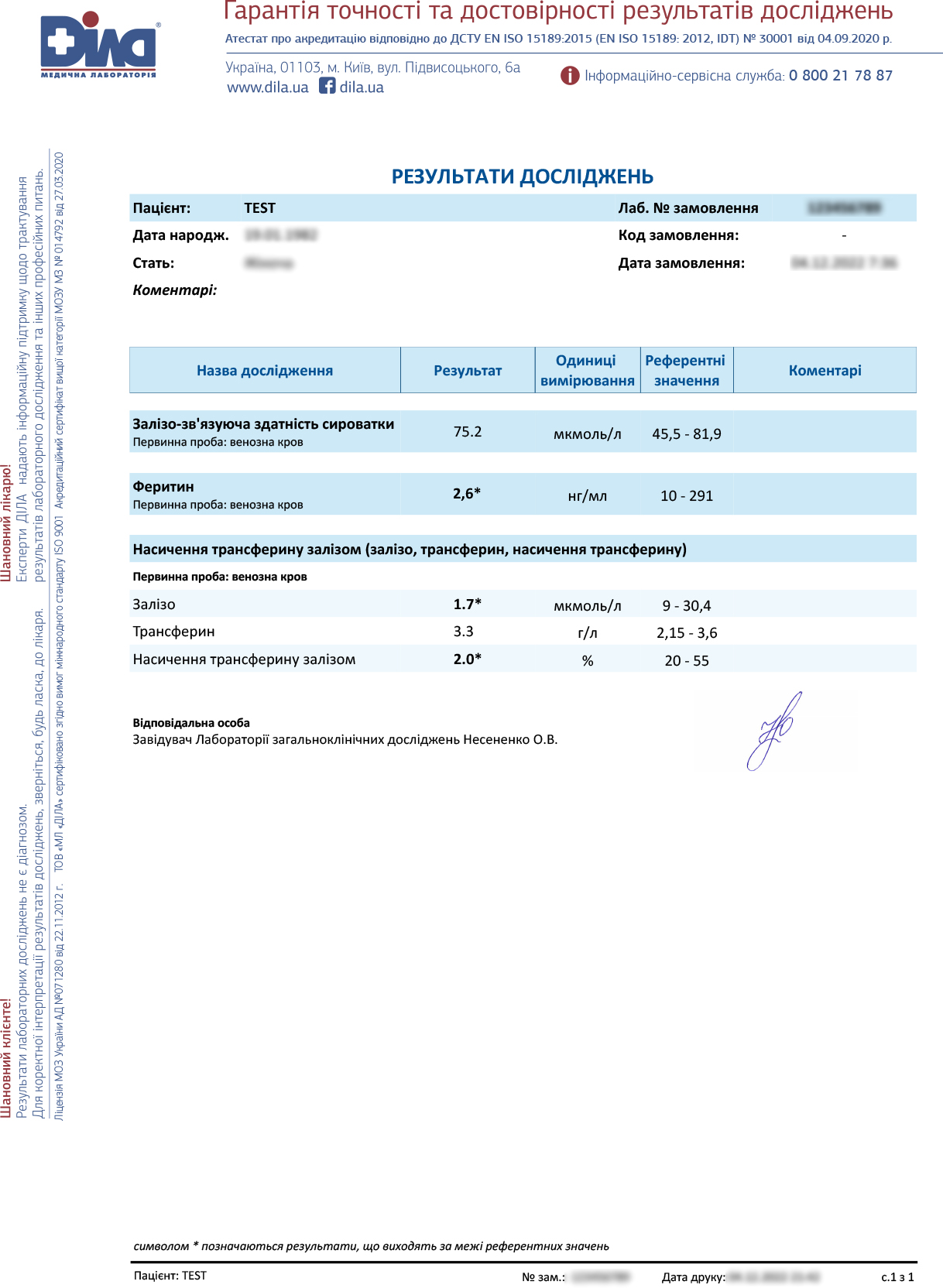
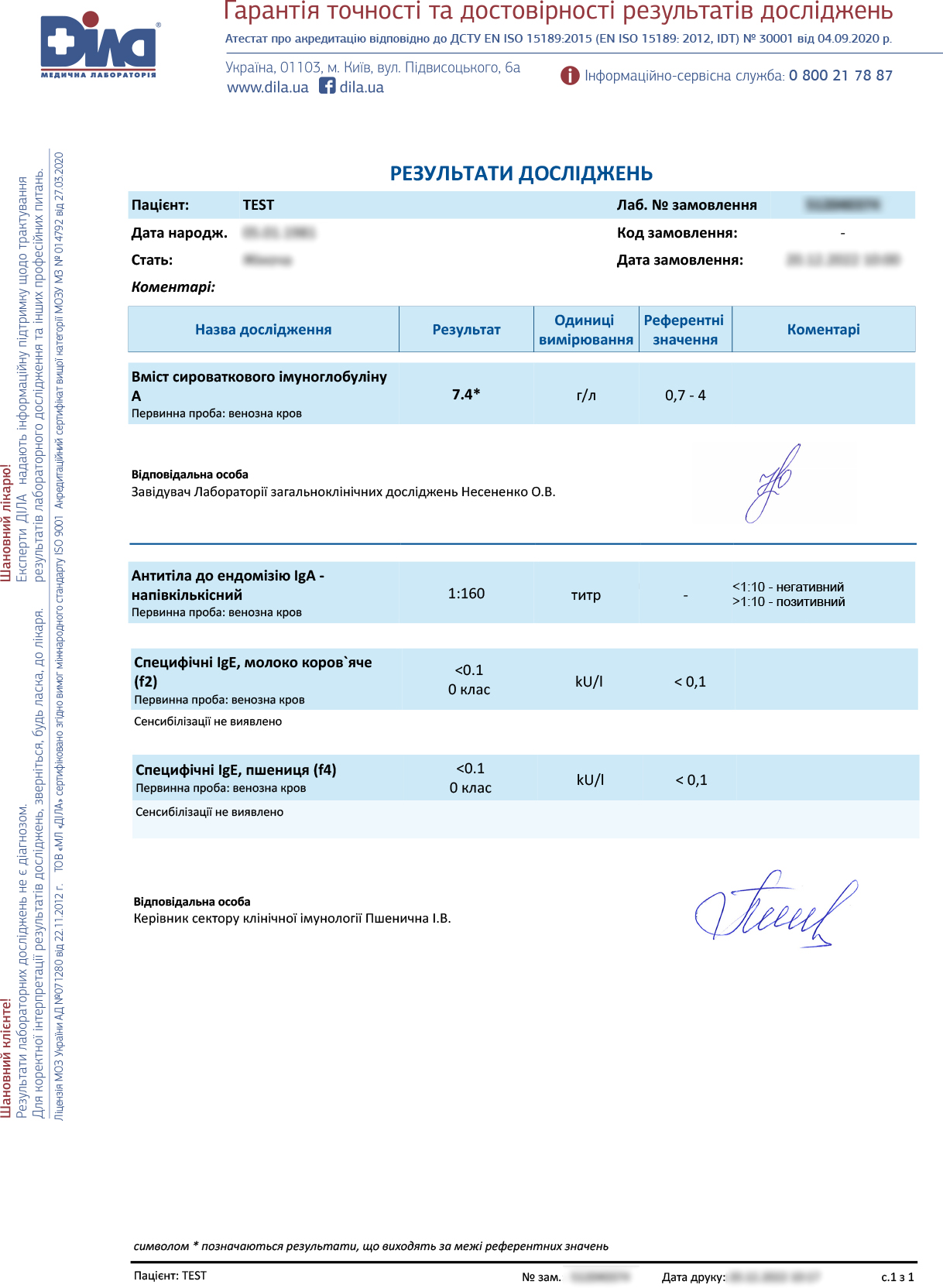
Через рік: гемоглобін — 116 г/л, АЛТ, АСТ — норма, феритин — 3.44 нг/мл ↓, залізо — 2.87 ↓ мкмоль/л.
Лікарі продовжили діагностичний пошук задля призначення адекватного лікування. Дівчина була обстежена на целіакію та на харчову алергію (гіперчутливість) до молока та злаків. Результати визначення специфічних Ig E — молоко коров’яче та пшениця – від’ємні. Враховучи, високі показники тканинної трансглутамінази Ig А ˃128 -у 20 разів ↑ N, ендомізію Ig А -160 у 16 разів↑ N, загального Ig А – 7,4 майже у 2 рази ↑N, у пацієнтки була запідозрена Целіакія. Генетично детерміноване аутоімунне захворювання з переважним ураженням тонкого кишківника, яке повʼязане з вживанням глютену, що надалі підтвердило генетичне обстеження.
Оскільки при целіакії аутоімунна запальна реакція спричиняє атрофію ворсинок слизової оболонки тонкого кишківника, що діагностується, завдяки біопсії: досліджуються біоптати забрані із цибулини та нисхідного відділу 12-ти палої кишки. Потрібно провести диференційну діагностику з іншими патологіями, а саме:
- Кишкові інфекції, лямбліоз
- Аутоімунна ентеропатія
- Еозинофільний гастроентерит
- Ентеропатії при імунодефіцитних станах, ВІЛ-ентеропатія
- Медикаментозна ентеропатія (антагоністи рецепторів ангіотензину 1, сартани, нестероїдні протизапальні)
- Т-клітинна лімфома
- Запальні захворювання кишечника
- Тропічний спру
- Хвороба Уіппла
- Синдром надлишкового бактеріального росту ( СНБР)
- Нр- інфекція (виразкова хвороба, хр. гастродуоденіт)
- Харчова гіперчутливість (непереносимість)
При цих станах також можлива атрофія та/або лімфоцитарна інфільтрація слизової оболонки тонкого кишківника.
В рамках діагностичного пошуку й враховуючи відмову від запропонованої раніше гастроскопії, пацієнтці рекомендовано пройти дослідження «Гастрокомплекс».
Аналізуючи, всю історію та розвиток хвороби дівчини, виникає питання: «Що стало причиною розвитку залізодефіцитної анемії при Целіакії?» При цьому захворюванні можливі декілька видів анемії: залізодефіцитна, анемія хронічного захворювання, анемія з дефіцитом вітамінна B 12 та фолієвої кислоти.
Причини розвитку саме залізодефіцитної анемії:
- Мальабсорбція заліза, внаслідок атрофії тонкого кишківника та імунного запального процесу у СО (у слизовій оболонці) кишківника
- Наявність супутніх захворювань кишківника (ЗЗК, лямбліоз)
- Приховані крововтрати з боку ШКТ (кишкові паразитози, медикаментозна ентеропатія, неоплазія кишківника, інфікування Helicobacter pylori)
- Підвищена потреба у залізі (підлітковий вік, вагітність, спортивні навантаження)
- Неадекватна дієта з низьким вмістом заліза (БГД не забезпечує достатньою кількістю заліза, не містить продукти, збагачені залізом на основі пшениці)
Пацієнтці встановлено діагноз: Целіакія та призначена пожиттєва безглютенова дієта.
Слід зазначити, що Целіакія — часто маскується неспецифічними симптомами, які ускладнюють встановлення точного діагнозу і не дозволяють розпочати своєчасне лікування наслідків захворювання. Специфіка полягає в тому, що ніякого медикаментозного лікування, спрямованого проти самої целіакії, немає. Єдиним радикальним способом боротьби може бути тільки дотримання суворої безглютенової дієти.
Джерела:
- https://www.health-ua.com/article/64500-nenvazivn-bomarkeri-udagnostitc-zapalnih-zahvoryuvan-kishechniku-udtej
- Abraham C., Cho J.H. Inflammatory bowel disease. N Engl J Med. 2009; 361(21): 2066-2078. doi:10.1056/NEJMra0804647.
- Faecal calprotectin diagnostic tests for inflammatory diseases of the bowel Diagnostics guidance [DG11]. Published date: 02 October 2013 https://www.nice.org.uk/guidance/dg11/chapter/3-Clinical-need-and-practice
- Денисова М.Ф. Современные подходы к диагностике язвенного колита у детей // Современная педиатрия. – 2014. – № 3. – С. 113-115. …
- Gies A. et al. Fecal immunochemical test for hemoglobin in combination with fecal transferrin in colorectal cancer screening. United European gastroenterology journal. – 2018; 6 (8): 1223-1231. doi: 10.1177/2050640618784053
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6169043.
- Niland B., Cash B.D. Health benefits and adverse effects of a gluten-free diet in non-celiac disease patients. Gastroenterol Hepatol (NY) 2018; 14: 82-91.
- Golley S., Corsini N., Topping D. et al. Motivations for avoiding wheat consumption in Australia: results from a population survey. Public Health Nutr 2015; 18: 490-499.
- ESPGHAN Guidelines for Diagnosing Coeliac Disease, 2019,2020
- Lebwohl B., Sanders D.S., Green P.H.R. Coeliac disease. Lancet 2018; 391: 70-81.
- Catassi C., Alaedini A., Bojarski C. et al. The overlapping area of non-celiac gluten sensitivity (NCGS) and wheat-sensitive irritable bowel syndrome (IBS): an update. Nutrients 2017; 9:pii: E1268.
- Tanpowpong P., Ingham T.R., Lampshire P.K. et al. Coeliac disease and gluten avoidance in New Zealand children. Arch Dis Child 2012; 97: 12-16.
- Aziz I., Lewis N.R., Hadjivassiliou M. et al. A UK study assessing the population prevalence of self-reported gluten sensitivity and referral characteristics to secondary care. Eur J Gastroenterol Hepatol 2014; 26: 33-39.
- Carroccio A., Giambalvo O., Blasca F. et al. Self-reported non-celiac wheat sensitivity in high school students: demographic and clinical characteristics. Nutrients 2017; 9: pii: E771.
- Volta U., Tovoli F., Cicola R. et al. Serological tests in gluten sensitivity (nonceliac gluten intolerance). J Clin Gastroenterol 2012; 46: 680-685.
- Carroccio A., Mansueto P., Iacono G. et al. Nonceliac wheat sensitivity diagnosed by double-blind placebo-controlled challenge: exploring a new clinical entity. Am J Gastroenterol 2012; 107: 1898-1906.
- Lovell R.M., Ford A.C. Global prevalence of and risk factors for irritable bowel syndrome: a meta-analysis. Clin Gastroenterol Hepatol 2012; 10: 712-721.
- Carroccio A., Mansueto P., D’Alcamo A., Iacono G. Nonceliac wheat sensitivity as an allergic condition: personal experience and narrative review. Am J Gastroenterol 2013; 108: 1845-1852.
- Hollon J., Puppa E.L., Greenwald B. et al. Effect of gliadin on permeability of intestinal biopsy explants from celiac disease patients and patients with nonceliac gluten sensitivity. Nutrients 2015; 7: 1565-1576.
- Sapone A., Lammers K.M., Casolaro V. et al. Divergence of gut permeability and mucosal immune gene expression in two gluten-associated conditions: celiac disease and gluten sensitivity. BMC Med 2011; 9: 23.
- Portincasa P., Bonfrate L., de Bari O. et al. Irritable bowel syndrome and diet. Gastroenterol Rep (Oxf) 2017; 5: 11-19.
- Vazquez-Roque M.I., Camilleri M., Smyrk T. et al. A controlled trial of gluten-free diet in patients with irritable bowel syndrome-diarrhea: effects on bowel frequency and intestinal function. Gastroenterology 2013; 144: 903.e3-911.e3.
- Wu R.L., Vazquez-Roque M.I., Carlson P. et al. Gluten-induced symptoms in diarrhea-predominant irritable bowel syndrome are associated with increased myosin light chain kinase activity and claudin-15 expression. Lab Invest 2017; 97: 14-23.
- Fritscher-Ravens A., Schuppan D., Ellrichmann M. et al. Confocal endomicroscopy shows food-associated changes in the intestinal mucosa of patients with irritable bowel syndrome. Gastroenterology 2014; 147: 1012.e4-1020.e4.
- Schuppan D., Zevallos V. Wheat amylase trypsin inhibitors as nutritional activators of innate immunity. Dig Dis 2015; 33: 260-263.
- Reig-Otero Y., Manes J., Manyes L. Amylase-trypsin inhibitors in wheat and other cereals as potential activators of the effects of nonceliac gluten sensitivity. J Med Food 2018; 21: 207-214.
- Gomez L., Martin E, Hernandez D. et al. Members of the alpha-amylase inhibitors family from wheat endosperm are major allergens associated with baker’s asthma. FEBS Lett 1990; 261: 85-88.
- Junker Y., Zeissig S., Kim S.J. et al. Wheat amylase trypsin inhibitors drive intestinal inflammation via activation of toll-like receptor 4. J Exp Med 2012; 209: 2395-2408.
- de Punder K., Pruimboom L. The dietary intake of wheat and other cereal grains and their role in inflammation. Nutrients 2013; 5: 771-787.
- Murray K., Wilkinson-Smith V., Hoad C. et al. Differential effects of FODMAPs (fermentable oligo-, di-, mono-saccharides and polyols) on small and large intestinal contents in healthy subjects shown by MRI. Am J Gastroenterol 2014; 109: 110-119.
- Spiller R. How do FODMAPs work? J Gastroenterol Hepatol 2017; 32 Suppl 1: 36-39.
- Catassi C., Elli L., Bonaz B. et al. Diagnosis of non-celiac gluten sensitivity (NCGS): the Salerno Experts’ Criteria. Nutrients 2015; 7: 4966-4977.