Сложный диагноз - анемия у девочки подросткового возраста
23.01.2023
По данным ВОЗ, анемией страдает около 24% населения планеты. Это состояние особенно присуще младенцам, детям и подросткам, беременным женщинам. Однако может развиваться также в других группах людей, независимо от возраста и пола. Причины — недостаточность железа в рационе, прием некоторых медикаментов, генетическая предрасположенность, наличие незаметно протекающих хронических заболеваний. Солдатова Оксана Владимировна – к. мед. н., доцент кафедры детских и подростковых заболеваний Национального университета здравоохранения Украины имени П.Л. Шупика, эксперт ДОЗ КГГА, вице-президент Независимой Ассоциации нутрициологов и диетологов Украины, поделилась сложным путем диагностического поиска у девочки-подростки, 17 лет.
Пациентка обратилась с жалобами, беспокоившими ее в течение года, на:
- периодическая абдоминальная боль после еды, которая уменьшалась после дефекации;
- вздутие живота;
- слабость, головокружение, понос 4-5 г. в сутки преимущественно после еды ( стул был жидким, светло-коричневого цвета со слизью)
- снижение веса за год на 6 кг;
- 4 эпизода диареи в год без гипертермии и рвоты, последний эпизод диареи и абдоминальной боли (в правом подреберье и мезогастрии) длился 2 недели.
Свои жалобы девушка связывает с психоэмоциональной нагрузкой, сменой питания, употреблением тяжелой пищи.
Согласно клиническому обследованию:
- кожа бледная, живот мягкий,
- умеренное вздутие,
- незначительная болезненность при пальпации толстого кишечника,
- умеренная болезненность в т. Кера,
- язык с незначительным желтоватым наслоением и умеренными отпечатками зубов;
другие органы и системы без особенностей.
В анамнезе жизни:
- аллергия на белок коровьего молока, яйца, цитрусовые – до 5 лет;
- перенесены кишечные инфекции, лямблиоз, аскаридоз.
Наследственность не отягощена.
В общем анализе крови анемия (гемоглобин – 69 г/л и 63 г/л при повторном обследовании), микроцитоз, анизоцитоз эритроцитов, гипохромия, нейтропения (32.5%), моноцитоз (16.2%), лимфоцитоз (48.2%), повышенное количество ретика (12%; 20% при повторе). Значительно снижены уровни железа (1.5 ммоль/л) и ферритина (2.5 нг/мл). В биохимии крови: повышенный уровень общего билирубина -26.9 мкмоль/л, АЛТ-143, АСТ-96. В копрограмме – значительное количество нейтрального жира и йодофильных бактерий – при повторном обследовании. По результатам УЗИ брюшной полости: увеличен желчный пузырь с крупнодисперсным содержимым.
Диагноз: Железодефицитная анемия средней степени тяжести. Функциональное билиарное расстройство сфинктера Оди. Билиарный сладж.
Рекомендуется дополнительное обследование на:
- гепатит (вирусный, токсический, криптогенный)
- гельминтоз (аскаридоз, токсокароз)
- паразитоз (лямблиоз, амебиаз)
- воспалительное заболевание кишечника
- синдром раздраженного кишечника
- пищевую аллергию или гиперчувствительность к молоку, яйцам, сое, злакам.
Пациентка была обследована на вирусный гепатит А (HAV) антитела IgM, вирус гепатита B (HBV), HBcorAg, антитела IgM, HBsAg, вирус гепатита C (HCV)- Anti-HCV IgG cor, NS3, NS4, NS5; цитомегаловирус-антитела IgМ, вирус Эпштейна-Барр – гетерофильные антитела IgM и получили отрицательные результаты.
Следующим шагом проводились диагностические тесты для выявления СПК (синдрома раздраженного кишечника) и ЗЗК (воспалительных заболеваний кишечника), ПЦР тест на Хеликобактерную инфекцию.
Следовательно, для того, чтобы отличить СПК (синдром раздраженного кишечника) от других кишечных расстройств, врачи должны отмечать хроническое и рецидивирующее течение СПК и знать диагностические критерии, основанные на частоте симптомов и их длительности. СПК является доброкачественным функциональным расстройством, которое не связано с увеличением смертности и не трансформируется в серьезное заболевание, однако значительно снижает качество жизни пациентов.
Согласно Римским критериям IV для СПК характерно:
Периодическая абдоминальная боль с частотой ≥1 эпизода в неделю за последние 3 мес, что ассоциируется с ≥2 критериями:
- Связь с актом дефекации
- Связь с изменением частоты стула
- Связь с изменением формы (внешнего вида) стула
Важным моментом является исключение так называемых клинических симптомов тревоги, к которым относятся:
- Семейный анамнез по ЗЗК
- Постоянный болевой синдром
- Гемоколиты
- Хроническая диарея (более 3 г в день более 2 недель), ночная диарея
- Лихорадка неизвестного генеза
- Потеря веса
- Артрит
- Постоянная рвота
- Параректальная боль (трещины, свищи)
- Дисфагия, одинофагия
- Гепато и/или спленомегалия
При наличии любого из перечисленных симптомов можно заподозрить органическое заболевание (кишечное или внекишечное), которое необходимо выявить.
Для пациентов с ЗЗК неинвазивных биомаркеров воспаления – выявление ФК (фекального кальпротектина) и исследование кала на скрытую кровь (наличие гемоглобина и трансферрина) – имеет высокую диагностическую и прогностическую значимость. Кальпротектин выделяется в больших количествах с калом при повреждении слизистой кишечника, является маркером активности лейкоцитов и воспаления в желудочно-кишечном тракте. Повышенный уровень кальпротектина показывает колоноскопию и биопсии.
Исследование кала на скрытую кровь (наличие гемоглобина и трансферрина) является неинвазивным маркером желудочно-кишечного кровотечения. Наличие гемоглобина в кале человека является специфическим маркером кровотечения из нижних отделов ЖКТ, поскольку гемоглобин – нестабильное соединение, превращающееся при прохождении по кишечнику. Трансферрин – более стабильное соединение и используется как маркер кровотечения как из верхних, так и из нижних отделов ЖКТ. Положительный результат исследования на содержание гемоглобина и трансферрина в кале свидетельствует о наличии кровотечения из верхних и нижних отделов ЖКТ и значительной вероятности кровотечения именно из нижних отделов. При отрицательном результате на наличие гемоглобина и положительном – на наличие трансферрина диагностируется кровотечение из верхних отделов ЖКТ, при положительном результате теста на гемоглобин и отрицательном на трансферрин – кровотечение из нижних отделов ЖКТ. Отсутствие гемоглобина и трансферрина в кале означает, что кровотечение отсутствует.
Использование обоих тестов – определение содержания гемоглобина и трансферрина в кале одновременно обеспечивает повышение эффективности диагностики и уменьшение выполнения необоснованных эндоскопических исследований, особенно у детей.
Результаты исследований пациентки:

По результатам исследований и пошаговой диагностики заболеваний:
- Язвенной болезни желудка/ДПК
- Атрофический гастрит
- Эозинофильного гастрита
- Болезни Крона
- Рака желудка
Девушке предложена гастроскопия (ФГДС) с биопсией и получен отказ.
В дальнейшем проведены отдельные исследования на гельминтозы: аскаридоз, токсокароз, анализ кала на яйца гельминтов – получены отрицательные результаты. Пациентка обследована на лямблиоз: получен положительный результат на общие антитела (IgG + IgM + IgA) Giardia lamblia и антиген лямблий в кале.
Установлен предварительный диагноз: Железодефицитная анемия средней степени тяжести. Лемблиоз. Функциональное билиарное расстройство сфинктера Оди. Билиарный сладж. Криптогенный гепатит.
Назначено соответствующее лечение, лабораторные исследования в динамике.
Лечение:
- противопаразитарные (альбендазол 5 дней 15 мг/кг)
- гепатопротекторы (гептрал, хофитол)
- энтеросорбенты (лактофильтрум)
- пробиотики (энтерол, лактиале)
- ферменты (креон)
- препараты железа (мальтофер (Fe III)) 100 мг 3 г/сутки 1 месяц
- сорбифер дурулес (Fe II) – 320 мг 2 г/сут) - 4 месяца
- фолиевая кислота 5 мг 3 г в сутки – 1 месяц, витамины В1, В6, В12 – 1 месяц
После 2 месяцев лечения уровень гемоглобина в ЗАК поднялся до 78 г/л, АЛТ-57, АСТ-48. В динамике у пациентки: общее состояние удовлетворительное, жалобы на периодическое вздутие живота, кал оформлен, регулярный, вес увеличился, улучшилось состояние волос и ногтей.
Уровни железа, ферритина, насыщение трансферрина железом остались низкими.
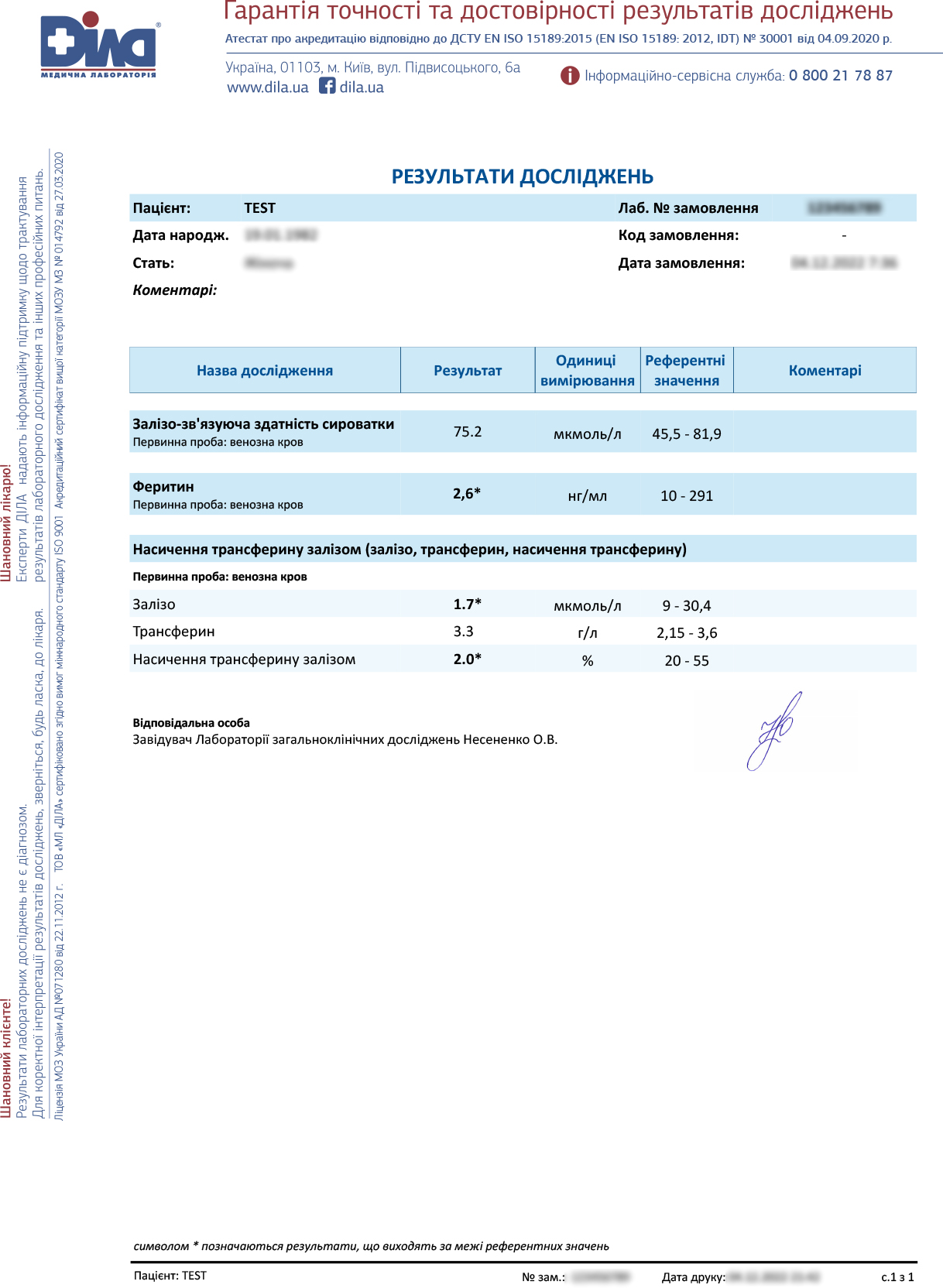
Через год: гемоглобин – 116 г/л, АЛТ, АСТ – норма, ферритин – 3.44 нг/мл ↓, железо – 2.87 ↓ мкмоль/л.
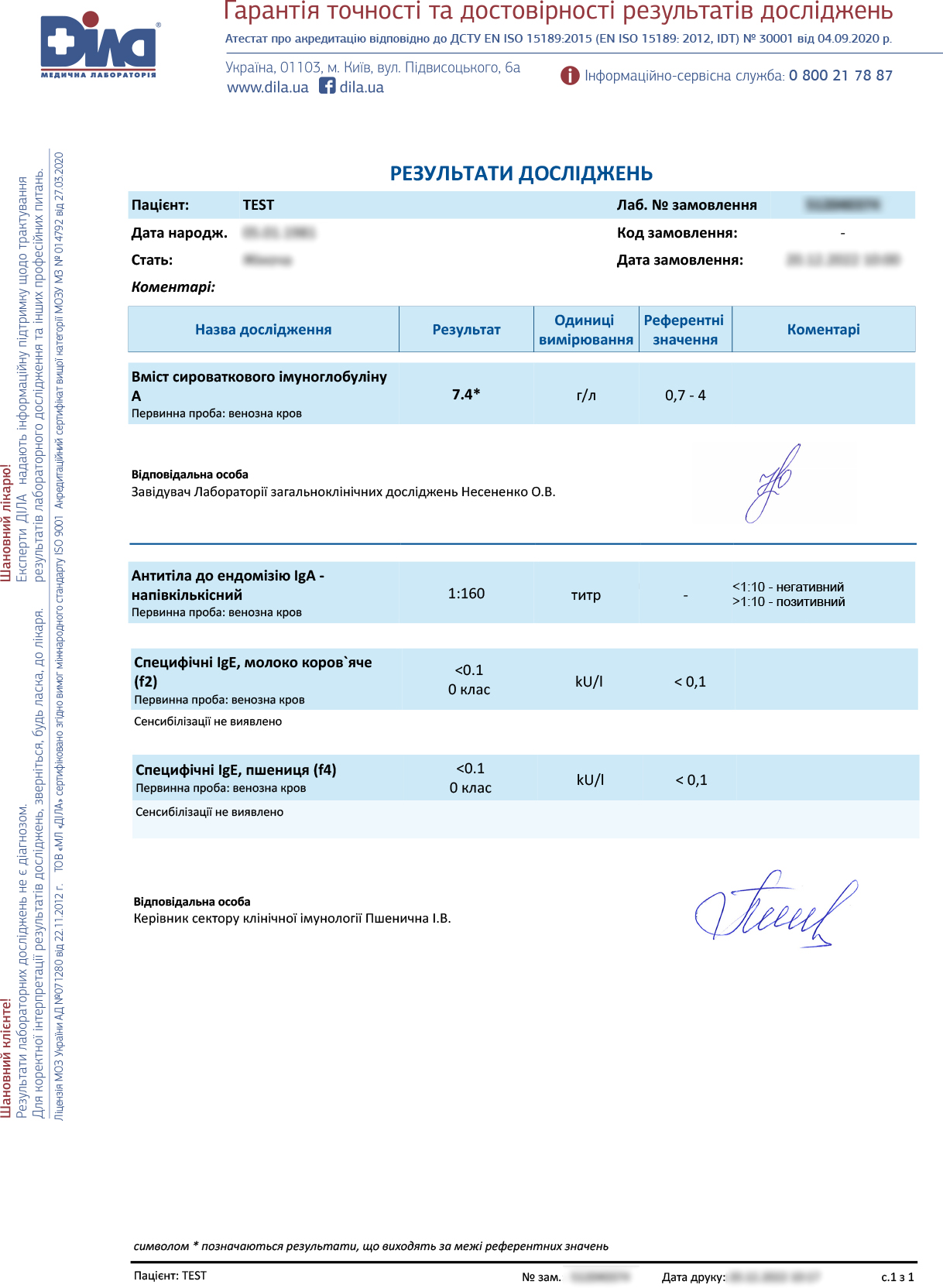
Врачи продолжили диагностический поиск для назначения адекватного лечения. Девушка была обследована на целиакию и пищевую аллергию (гиперчувствительность) к молоку и злакам. Результаты определения специфических Ig E – молоко коровье и пшеница – отрицательные. Учитывая высокие показатели тканевой трансглутаминазы Ig А ˃128 - в 20 раз ↑ N, эндомизию Ig А -160 в 16 раз ↑ N, общего Ig А – 7,4 почти в 2 раза ↑ N, у пациентки была заподозрена Целиакия. Генетически детерминированное аутоиммунное заболевание с преимущественным поражением тонкого кишечника, которое связано с употреблением глютена, что в дальнейшем подтвердило генетическое обследование.
Поскольку при целиакии аутоиммунная воспалительная реакция вызывает атрофию ворсинок слизистой диагностируемого тонкого кишечника благодаря биопсии: исследуются биоптаты забранные из луковицы и нисходящего отдела 12-ти перстной кишки. Нужно провести дифференциальную диагностику с другими патологиями, а именно:
- Кишечные инфекции, лямблиоз
- Аутоиммунная энтеропатия
- Эозинофильный гастроэнтерит
- Энтеропатии при иммунодефицитных состояниях, ВИЧ-энтеропатия
- Медикаментозная энтеропатия (антагонисты рецепторов ангиотензина 1, сартаны, противовоспалительные нестероидные)
- Т-клеточная лимфома
- Воспалительные заболевания кишечника
- Тропическая спру
- Болезнь Уиппла
- Синдром избыточного бактериального роста (СНБР)
- Нр-инфекция (язвенная болезнь, хр. Гастродуоденит)
- Пищевая гиперчувствительность (непереносимость)
При этих состояниях возможна атрофия и/или лимфоцитарная инфильтрация слизистой тонкого кишечника.
В рамках диагностического поиска и учитывая отказ от предложенной ранее гастроскопии, пациентке рекомендовано пройти исследование Гастрокомплекс.
Анализируя всю историю и развитие болезни девушки, возникает вопрос: «Что стало причиной развития железодефицитной анемии при Целиакии?». При этом заболевании возможны несколько видов анемии железодефицитная, анемия хронического заболевания, анемия с дефицитом витаминная B 12 и фолиевой кислоты.
Причины развития железодефицитной анемии:
- Мальабсорбция железа вследствие атрофии тонкого кишечника и иммунного воспалительного процесса в СО (в слизистой) кишечника
- Наличие сопутствующих заболеваний кишечника (ЗЗК, лямблиоз)
- Скрытые кровопотери со стороны ЖКТ (кишечные паразитозы, медикаментозная энтеропатия, неоплазия кишечника, инфицирование Helicobacter pylori)
- Повышенная потребность в железе (подростковый возраст, беременность, спортивные нагрузки)
- Неадекватная диета с низким содержанием железа (БГД не обеспечивает достаточное количество железа, не содержит продукты, обогащенные железом на основе пшеницы)
Пациентке установлен диагноз: Целиакия и пожизненная безглютеновая диета.
Следует отметить, что Целиакия часто маскируется неспецифическими симптомами, которые затрудняют установление точного диагноза и не позволяют начать своевременное лечение последствий заболевания. Специфика состоит в том, что никакого медикаментозного лечения, направленного против самой целиакии, нет. Единственным радикальным способом борьбы может быть только соблюдение суровой безглютеновой диеты.
Источники:
- https://www.health-ua.com/article/64500-nenvazivn-bomarkeri-udagnostitc-zapalnih-zahvoryuvan-kishechniku-udtej
- Abraham C., Cho J.H. Inflammatory bowel disease. N Engl J Med. 2009; 361(21): 2066-2078. doi:10.1056/NEJMra0804647.
- Faecal calprotectin diagnostic tests for inflammatory diseases of the bowel Diagnostics guidance [DG11]. Published date: 02 October 2013 https://www.nice.org.uk/guidance/dg11/chapter/3-Clinical-need-and-practice
- Денисова М.Ф. Современные подходы к диагностике язвенного колита у детей // Современная педиатрия. – 2014. – № 3. – С. 113-115. …
- Gies A. et al. Fecal immunochemical test for hemoglobin in combination with fecal transferrin in colorectal cancer screening. United European gastroenterology journal. – 2018; 6 (8): 1223-1231. doi: 10.1177/2050640618784053
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6169043.
- Niland B., Cash B.D. Health benefits and adverse effects of a gluten-free diet in non-celiac disease patients. Gastroenterol Hepatol (NY) 2018; 14: 82-91.
- Golley S., Corsini N., Topping D. et al. Motivations for avoiding wheat consumption in Australia: results from a population survey. Public Health Nutr 2015; 18: 490-499.
- ESPGHAN Guidelines for Diagnosing Coeliac Disease, 2019,2020
- Lebwohl B., Sanders D.S., Green P.H.R. Coeliac disease. Lancet 2018; 391: 70-81.
- Catassi C., Alaedini A., Bojarski C. et al. The overlapping area of non-celiac gluten sensitivity (NCGS) and wheat-sensitive irritable bowel syndrome (IBS): an update. Nutrients 2017; 9:pii: E1268.
- Tanpowpong P., Ingham T.R., Lampshire P.K. et al. Coeliac disease and gluten avoidance in New Zealand children. Arch Dis Child 2012; 97: 12-16.
- Aziz I., Lewis N.R., Hadjivassiliou M. et al. A UK study assessing the population prevalence of self-reported gluten sensitivity and referral characteristics to secondary care. Eur J Gastroenterol Hepatol 2014; 26: 33-39.
- Carroccio A., Giambalvo O., Blasca F. et al. Self-reported non-celiac wheat sensitivity in high school students: demographic and clinical characteristics. Nutrients 2017; 9: pii: E771.
- Volta U., Tovoli F., Cicola R. et al. Serological tests in gluten sensitivity (nonceliac gluten intolerance). J Clin Gastroenterol 2012; 46: 680-685.
- Carroccio A., Mansueto P., Iacono G. et al. Nonceliac wheat sensitivity diagnosed by double-blind placebo-controlled challenge: exploring a new clinical entity. Am J Gastroenterol 2012; 107: 1898-1906.
- Lovell R.M., Ford A.C. Global prevalence of and risk factors for irritable bowel syndrome: a meta-analysis. Clin Gastroenterol Hepatol 2012; 10: 712-721.
- Carroccio A., Mansueto P., D’Alcamo A., Iacono G. Nonceliac wheat sensitivity as an allergic condition: personal experience and narrative review. Am J Gastroenterol 2013; 108: 1845-1852.
- Hollon J., Puppa E.L., Greenwald B. et al. Effect of gliadin on permeability of intestinal biopsy explants from celiac disease patients and patients with nonceliac gluten sensitivity. Nutrients 2015; 7: 1565-1576.
- Sapone A., Lammers K.M., Casolaro V. et al. Divergence of gut permeability and mucosal immune gene expression in two gluten-associated conditions: celiac disease and gluten sensitivity. BMC Med 2011; 9: 23.
- Portincasa P., Bonfrate L., de Bari O. et al. Irritable bowel syndrome and diet. Gastroenterol Rep (Oxf) 2017; 5: 11-19.
- Vazquez-Roque M.I., Camilleri M., Smyrk T. et al. A controlled trial of gluten-free diet in patients with irritable bowel syndrome-diarrhea: effects on bowel frequency and intestinal function. Gastroenterology 2013; 144: 903.e3-911.e3.
- Wu R.L., Vazquez-Roque M.I., Carlson P. et al. Gluten-induced symptoms in diarrhea-predominant irritable bowel syndrome are associated with increased myosin light chain kinase activity and claudin-15 expression. Lab Invest 2017; 97: 14-23.
- Fritscher-Ravens A., Schuppan D., Ellrichmann M. et al. Confocal endomicroscopy shows food-associated changes in the intestinal mucosa of patients with irritable bowel syndrome. Gastroenterology 2014; 147: 1012.e4-1020.e4.
- Schuppan D., Zevallos V. Wheat amylase trypsin inhibitors as nutritional activators of innate immunity. Dig Dis 2015; 33: 260-263.
- Reig-Otero Y., Manes J., Manyes L. Amylase-trypsin inhibitors in wheat and other cereals as potential activators of the effects of nonceliac gluten sensitivity. J Med Food 2018; 21: 207-214.
- Gomez L., Martin E, Hernandez D. et al. Members of the alpha-amylase inhibitors family from wheat endosperm are major allergens associated with baker’s asthma. FEBS Lett 1990; 261: 85-88.
- Junker Y., Zeissig S., Kim S.J. et al. Wheat amylase trypsin inhibitors drive intestinal inflammation via activation of toll-like receptor 4. J Exp Med 2012; 209: 2395-2408.
- de Punder K., Pruimboom L. The dietary intake of wheat and other cereal grains and their role in inflammation. Nutrients 2013; 5: 771-787.
- Murray K., Wilkinson-Smith V., Hoad C. et al. Differential effects of FODMAPs (fermentable oligo-, di-, mono-saccharides and polyols) on small and large intestinal contents in healthy subjects shown by MRI. Am J Gastroenterol 2014; 109: 110-119.
- Spiller R. How do FODMAPs work? J Gastroenterol Hepatol 2017; 32 Suppl 1: 36-39.
- Catassi C., Elli L., Bonaz B. et al. Diagnosis of non-celiac gluten sensitivity (NCGS): the Salerno Experts’ Criteria. Nutrients 2015; 7: 4966-4977.