Алергія на пшеницю: сучасний підхід до діагностики
17.07.2025
Поширеність глютену в раціоні людини
Зернові культури, що містять глютен, стали фундаментальною частиною раціону людини, а пшениця є найбільш споживаною злаковою культурою у світі [Publishing, O. OECD-FAO Agricultural Outlook 2019–2028; Organisation for Economic Co-Operation and Development OECD: Rome, Italy, 2019]. Її широке використання в харчовій промисловості підкреслює значення пшениці як важливого поживного компонента [Al-Toma, A.; Volta, U.; Auricchio, R.; Castillejo, G.; Sanders, D.S.; Cellier, C.; Mulder, C.J.; Lundin, K.E. European Society for the Study of Coeliac Disease (ESsCD) Guideline for Coeliac Disease and Other Gluten-Related Disorders. United Eur. Gastroenterol. J. 2019, 7, 583–613].
Глютен, що переважно складається з білків запасу, є основним структурним білком пшениці. Побічні реакції на вживання глютену класифікуються за трьома основними патофізіологічними механізмами:
1. Аутоімунні реакції, наприклад, целіакія (ЦЛ).
2. Неаутоімунні та неалергічні реакції, прикладом яких є нецеліакійна чутливість до глютену (NCGS).
3. Алергічні причини.
Алергічні реакції можуть бути спричинені IgE-опосередкованими, змішаними IgE/не-IgE-опосередкованими та не-IgE-опосередкованими механізмами.
Пшениця як алерген та пов'язані з нею клінічні прояви
Останніми роками пшениця (Triticum spp.) набула визнання як значущий харчовий алерген, що стоїть поряд з такими відомими алергенами, як коров'яче молоко, яйця, соя та арахіс.
Харчова алергія на пшеницю характеризується виробленням IgE-антитіл до білків пшениці та розвитком симптомів негайного типу. Хоча в цілому алергія на пшеницю є відносно рідкісним явищем, у деяких регіонах, зокрема в частинах Азії (включаючи Японію та Таїланд), вона стала основною причиною харчової алергії [Srisuwatchari W, Vichyanond P (2018) Oral food challenges: result of a 16-year experience at a major teaching hospital in Thailand. Asia Pac Allergy 8:e21].
При IgE-опосередкованих реакціях клінічна картина може варіюватися від легких шкірно-слизових проявів, таких як кропив'янка та/або ангіонабряк, до загрозливої для життя анафілаксії. Важливо зазначити, що хоча T-клітини відіграють центральну роль у патофізіології атопічного дерматиту (АД) та еозинофільних шлунково-кишкових розладів, значна підгрупа пацієнтів також демонструє супутні IgE-опосередковані механізми. Такі реакції класифікуються як змішані IgE/не-IgE-опосередковані. Не-IgE-опосередковані реакції, своєю чергою, переважно вражають шлунково-кишковий тракт, проявляючись як синдром ентероколіту, індукованого харчовим білком (FPIES), або ентеропатія, індукована харчовим білком.
Унікальні форми алергії на пшеницю: WDEIA та WANDA
IgE-опосередкований механізм також охоплює унікальний стан, відомий як анафілаксія, індукована фізичними вправами, залежна від пшениці (WDEIA). Це окрема клінічна одиниця, при якій анафілаксія виникає лише в тому випадку, коли після вживання пшениці відбувається фізичне навантаження.
Останні дослідження показують, що інші кофактори, такі як нестероїдні протизапальні препарати (НПЗП) або алкоголь, також можуть посилювати реакції, а в деяких випадках навіть провокувати симптоми за відсутності фізичних вправ. Ця ширша клінічна картина отримала назву алергія на пшеницю, залежна від факторів аугментації (WANDA).
Було запропоновано різні механізми для пояснення того, як фізичні вправи діють як кофактор при WDEIA, однак підтверджувальні дані залишаються обмеженими. Це підкреслює необхідність подальших досліджень для з'ясування основної патофізіології цих станів. Примітним прикладом, що демонструє складність алергії на пшеницю, є спалах алергічної контактної кропив'янки, анафілаксії та/або WDEIA в Японії, пов'язаний з використанням мила для обличчя, що містить специфічний тип гідролізованого пшеничного білка [Yagami A, Aihara M, Ikezawa Z, Hide M, Kishikawa R, Morita E et al (2017) Outbreak of immediate-type hydrolyzed wheat protein allergy due to a facial soap in Japan. J Allergy Clin Immunol 140:879-881.e877].
Класифікація білків пшениці та їхня алергенна значущість
Білки пшениці можна класифікувати на дві основні категорії:
1. Водорозчинні (альбуміни)/солерозчинні (глобуліни).
2. Спирто-/водорозчинні (мономерні гліадини) та розчинні в розведеній кислоті (полімерні глютеніни).
До групи водо/солерозчинних білків належать інгібітори альфа-амілази (AAI, Tri a 15), білки переносу ліпідів (LTP, Tri a 14) та авенін-подібні білки.
Гліадини, які є спирто/водорозчинними, поділяються на:
- альфа (α)/бета (β)-гліадин (Tri a 21)
- гамма (γ)-гліадин (Tri a 20)
- омега (ω)-5-гліадин (Tri a 19)
Глютеніни, розчинні в розведеній кислоті, складаються з високомолекулярного глютеніну (HMW, Tri a 26) та низькомолекулярного глютеніну (LMW, Tri a 36).
Найбільш алергенними білками пшениці, що відповідають за IgE-опосередковану алергію на пшеницю, є гліадини, зокрема ω-5-гліадин, та глютеніни. У випадках анафілаксії, індукованої фізичними вправами, залежної від пшениці (WDEIA), ω-5-гліадин та LTP були визначені як основні алергени.
Перехресна реактивність білків злакових культур
Гліадини та глютеніни, які є основними запасними білками в зернах пшениці, належать до родини проламінів злаків (глютен). Проламіни пшениці демонструють значний ступінь гомології послідовності та структури з аналогічними білками в інших злакових, таких як ячмінь (гордеїни), жито (секаліни), овес (авеніни) та кукурудза (коіксини), а також, меншою мірою, з деякими видами трав. Ця гомологія призводить до значної перехресної реактивності in vitro між цими зерновими культурами. Однак клінічна перехресна реактивність, як правило, викликає менше занепокоєння.
У країнах, де пилок злаків є основною причиною сенсибілізації у пацієнтів з алергією, перехресна реактивність між тимофіївкою та пшеницею є поширеним явищем. Ця перехресна реактивність включає два відомі алергени, присутні як у пшениці, так і в пилку трав: вуглеводні детермінанти (CCD) та профіліни. У таких пацієнтів зазвичай спостерігається низький рівень специфічних IgE до пшениці (sIgE) і вони залишаються безсимптомними.
Дослідження Нільссона та співавт. (2018) Nilsson N, Nilsson C, Ekoff H, Wieser-Pahr S, Borres MP, Valenta R et al (2018) Grass-allergic children frequently show asympto- matic low-level IgE co-sensitization and cross-reactivity to wheat. Int Arch Allergy Immunol 177:135–144. https://doi.org/10.1159/ 000489610] показало, що 43 із 72 дітей (59,7%) з діагностованою лікарем алергією на пилок трав були сенсибілізовані до пшениці, із середнім рівнем sIgE 0,5 kUA/l. Це підкреслює важливість розуміння потенційної, хоча часто безсимптомної, перехресної сенсибілізації у пацієнтів з алергією на пилок злаків.
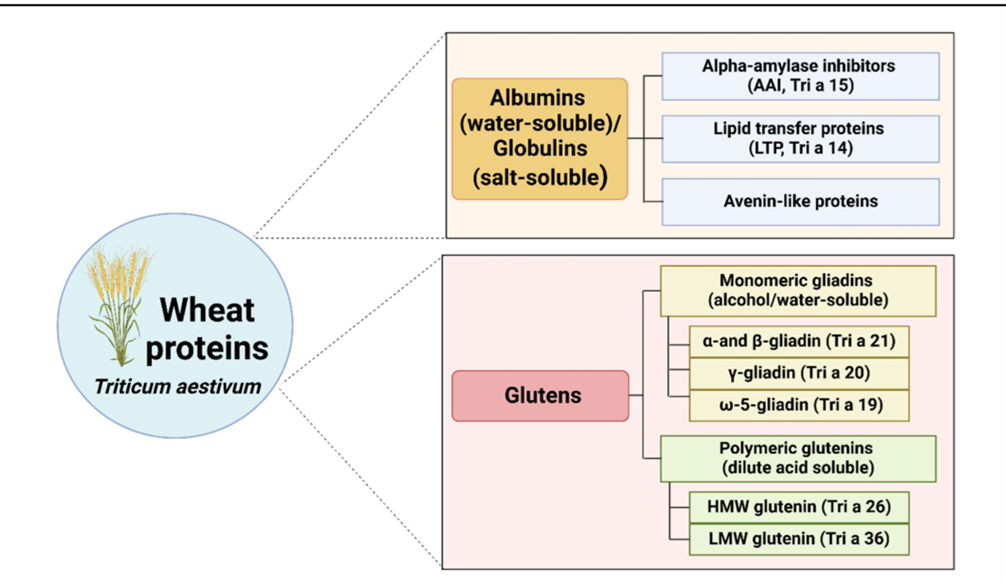
Рис. 1. Основні алергени білка пшениці. Створено BioRender.com/Mahidol University (дата звернення: 31 січня 2025 р.) [Clinical Reviews in Allergy & Immunology (2025) 68:47]
Діагностика IgE-опосередкованої алергії на пшеницю
Діагностика IgE-опосередкованої алергії на пшеницю традиційно ґрунтується на ретельному клінічному анамнезі в поєднанні з шкірними прик-тестами (ШПТ) та/або вимірюванням сироваткового специфічного IgE (sIgE).
Для підвищення точності діагностики критично важливим є визначення sIgE до компонентів пшениці, а саме:
- rTri a 19 (омега-5 гліадин): вважається головним алергеном пшениці та є маркером істинної сенсибілізації до пшениці.
- rTri a 14.
Дослідження на харчові sIgE широко доступні в клінічній практиці та зазвичай використовуються для діагностики алергії на пшеницю. Вони також можуть допомогти спрогнозувати тяжкість реакцій. Однак позитивні результати sIgE завжди слід інтерпретувати з урахуванням клінічного анамнезу, оскільки позитивний результат за відсутності клінічних симптомів вказує лише на сенсибілізацію без клінічного значення. Наразі ImmunoCAP, флуоресцентний метод, є стандартом для кількісного визначення sIgE.
Молекулярна алергодіагностика для уточнення алергенів пшениці
Для ідентифікації специфічних алергенів пшениці, таких як ω-5-гліадин, та підвищення діагностичної точності була розроблена молекулярна алергодіагностика. Метод флуоресцентного імуноферментного дослідження (FEIA) ImmunoCAP® дозволяє ідентифікувати обмежений спектр алергенів пшениці, зокрема гліадин, ω-5-гліадин (Tri a 19) та неспецифічний білок переносу ліпідів (ns-LTP, Tri a 14).
Враховуючи, що ω-5-гліадин є основним алергеном при IgE-опосередкованій алергії на пшеницю, визначення рівня ω-5-гліадин-sIgE може забезпечити більш точний діагноз, ніж загальний sIgE до пшениці.
Виклики та оптимізація діагностики алергії на пшеницю
Слід зазначити, що точність діагностики алергії на пшеницю все ще є нижчою порівняно з іншими поширеними харчовими алергенами. Як наслідок, постановка точного діагнозу може бути складною та часто вимагає проведення перорального харчового провокаційного тесту (ПХТ). Цей метод є трудомістким і несе значні ризики, особливо для дітей молодшого віку. Тому критично важливим є вибір відповідного методу та обладнання для діагностичних досліджень.
ДІЛА пропонує оптимальний варіант досліджень, які проводяться за допомогою методу ImmunoCAP. Цей метод забезпечує високу точність завдяки:
- Високій відтворюваності результатів: Кількісне визначення специфічних IgE-антитіл, підтверджене понад 5000 міжнародних наукових публікацій.
- Повній автоматизації процесу: Виключення людського фактора та мінімізація можливих похибок.
Значення молекулярного пакету "Пшениця"
Молекулярний пакет "Пшениця" від ДІЛА дозволяє визначити сенсибілізацію до алергокомпоненту пшениці rTri a 19 (омега-5 гліадин). Це є ключовим показником справжньої харчової алергії на пшеницю та допомагає прогнозувати тяжкі алергічні реакції при вживанні пшениці та наявності кофакторів (наприклад, WDEIA-синдром).
Крім того, виявлення сенсибілізації до компоненту пшениці Tri a 14 є корисним для диференційної діагностики перехресних реакцій з іншими рослинними алергенами та для доказового обґрунтування необхідності елімінації пшениці з раціону.
Висновки
Алергія на пшеницю, що є комплексною та багатогранною імунною відповіддю, становить значний діагностичний виклик у клінічній практиці. На відміну від целіакії чи нецеліакійної чутливості до глютену, істинна алергія на пшеницю характеризується IgE-опосередкованими механізмами та може проявлятися від легких шкірно-слизових реакцій до загрозливої для життя анафілаксії, включно з унікальними феноменами, такими як анафілаксія, індукована фізичними вправами, залежна від пшениці (WDEIA) та алергія на пшеницю, залежна від факторів аугментації (WANDA).
Точна діагностика вимагає поєднання детального клінічного анамнезу та вимірювання специфічних IgE-антитіл. Зокрема, молекулярна алергодіагностика, що визначає IgE до ключових алергокомпонентів пшениці, таких як ω-5-гліадин (rTri a 19) та Tri a 14, значно підвищує точність і дозволяє диференціювати істинну алергію на пшеницю від перехресних реакцій (наприклад, з пилком злаків).
Застосування високоточних методів, як-от ImmunoCAP, що забезпечують кількісне визначення специфічних IgE-антитіл та мінімізують вплив людського фактора завдяки повній автоматизації, є критично важливим для надійних результатів. Це дозволяє лікарям не тільки підтвердити діагноз, а й прогнозувати потенційну тяжкість реакцій, що є основою для ефективного управління станом пацієнта та розробки індивідуальних рекомендацій щодо елімінаційної дієти.















