Клініко-лабораторний менеджмент діагностики целіакії
27.10.2022
Що ми знаємо про розповсюдженість целіакії? Базуючись на європейських та американських серологічних скринінгових дослідженнях вважається, що безсимптомна целіакія спостерігається з частотою 1/100-300, а симптомна ~1/3 345. Зустрічається у 2 рази частіше у жінок, ніж у чоловіків. Однак і досі відкритим лишається питання недіагностованої целіакії. Про актуальні проблеми діагностики та лікування целіакії розповіла Солдатова Оксана Володимирівна – к. мед. н., доцент кафедри дитячих і підліткових захворювань Національного університету охорони здоров’я України імені П.Л. Шупика, експерт ДОЗ КМДА, віце-президент Незалежної Асоціації нутріциологів та дієтологів України під час Симпозіуму opinion leaders нутриціології та дієтології з міжнародною участю «Чи можливо зберегти оптимальне харчування в звичайних та екстремальних умовах?».
Різноманітність симптомів, які виникають внаслідок пошкодження багатьох органів у зв’язку з порушенням функції тонкого кишківника, а також часта комбінація целіакії з іншими аутоімунними захворюваннями, є причиною не діагностованої целіакції, хоча можливості медицини дозволяють її визначити. У медичному середовищі і досі побутують міфи щодо діагностики целіакії:
Міф 1: Виявлення хвороби можливе тільки у дитячому віці,
Міф 2: Целіакія супроводжується гастроінтестінальними симптомами:
- хронічна або періодична діарея,
- хронічний закреп,
- хронічні болій в животі,
- метеоризм,
- періодичної нудоти,
- періодичної блювоти.
Міф 3: для діагностики целіакії обов’язковим є визначення тільки імуноглобулінів до гліадину.
Насправді целіакію можна діагностувати у будь-якому віці (у дорослого) і дуже часто вона має поза інтестінальні симптоми, а саме:
- втрату ваги,
- недостатній приріст ваги у дітей,
- затримку росту (або низький зріст),
- затримку статевого дозрівання,
- аменорею,
- дратівливість,
- хронічну втому,
- нейропатію,
- артрит (або артралгію),
- хронічну залізодефіцитну анемію,
- зниження мінералізації кісток (остеопенію/остеопороз),
- повторні переломи,
- рецидивуючий афтозний стоматит,
- герпетиформний дерматит,
- дефекти зубної емалі,
- аномальну біохімію печінки (збільшення АЛТ, АСТ),
- симптоми хвороби можуть бути відсутні.
Важливу роль у діагностиці відіграє визначення імуноглобулінів до тканинної трансглютамінази, ендомізію та дезамінованого гліадину. Рекомендують також пройти генетичне тестування для виключення або підтвердження целіакії.
То, що ж таке целіакія? Целіакія — це генетично детерміноване аутоімунне захворювання з переважним ураженням тонкого кишківника, яке пов’язане з вживанням в їжу глютена. Глютен — група білків: проламінів та глютенінів, що входять до складу: зернових злаків (пшениця, жито, ячмінь, овес), споріднених видів пшениці (полба, хорасан, еммер, ейнкорн, тритикалє, спельта). Проламіни: пшениця (гліадин), ячмінь (гордеїн), жито (секалін), овес (авенін) надають тісту еластичність та пружність. Наприклад: до складу білків пшениці входять: гліадини 40%, глютеніни 40%, альбуміни- 10%, глобуліни – 10%. Аутоімунне запалення слизової оболонки тонкого кишківника-целіакія- викликає порушення всіх його функцій, а саме травлення, засвоєння, секреторної і рухової діяльності.
Важливо зазначити, що якщо в раціоні присутній глютен, імунна система хворого на целіакію перебуває під постійним антигенним тиском, внаслідок чого можуть виникати інші аутоімунні захворювання. Під впливом глютену утворюються специфічні антитіла (до тканинної трансглютамінази типу 2 [tTG], антиендомізіальні [EMA], до дезамінованих пептидів гліадину [DGP]) і розвивається аутоімунна запальна реакція, яка призводить до атрофії ворсинок слизової оболонки тонкого кишківника.
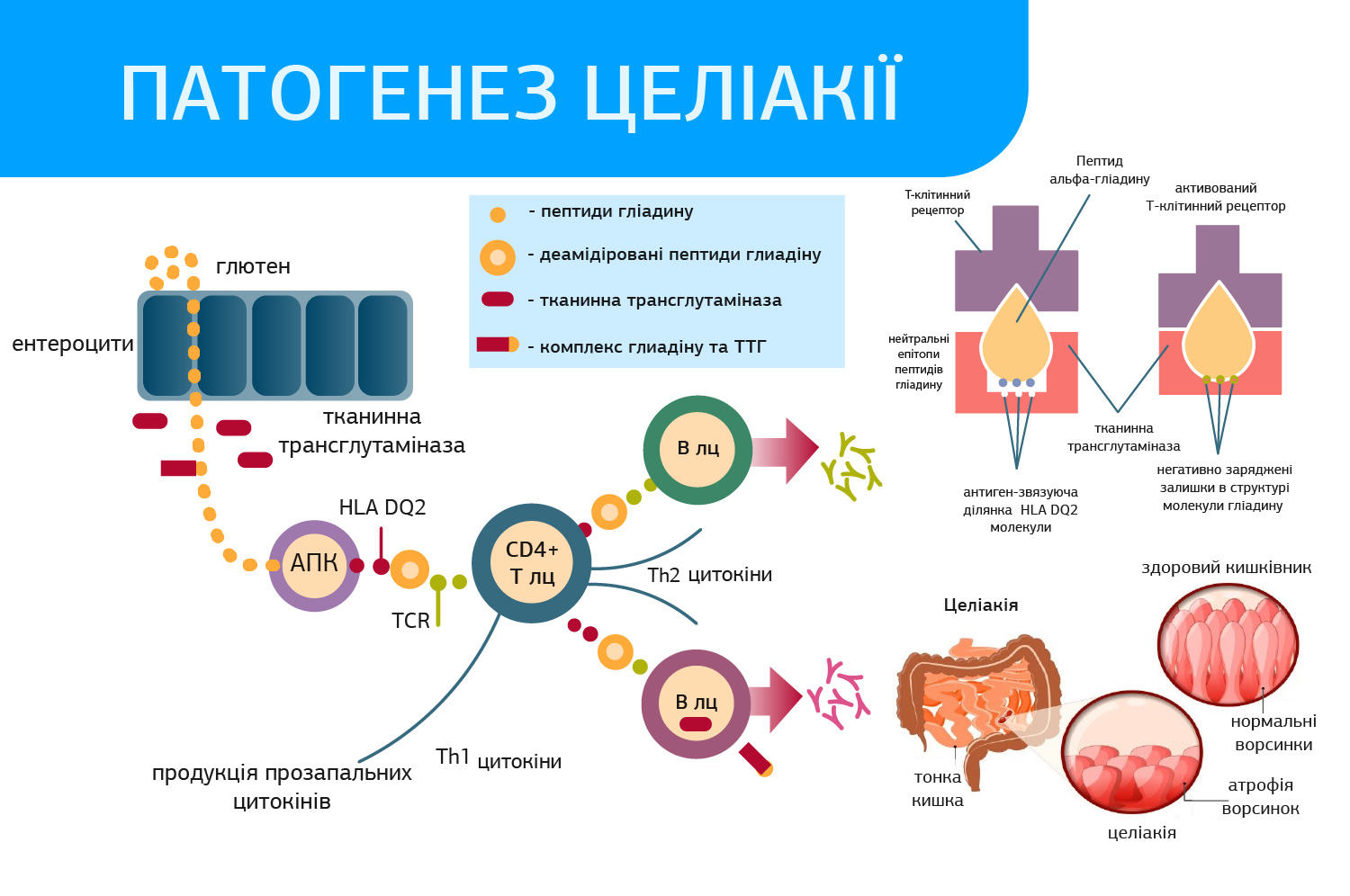
Антитіла можна виявити у ≈1 % загальної популяції; ризик целіакії підвищений у хворих на цукровий діабет 1-го типу, аутоімунні захворювання печінки і/або щитовидної залози, з синдромом Дауна, з синдромом Шерешевського-Тернера, з синдромом Вільямса, з нефропатією IgA, з дефіцитом IgA та у родичів 1-го ступеня хворих на целіакію.
Важливий вплив на розвиток Целіакії мають фактори навколишнього середовища, тобто:
- Склад мікробіоти кишківника (гестаційний вік при народженні дитини, тип вигодовування, кишкові інфекції, антибактеріальні препарати):
- зменшення гідролізу глютену у просвіті кишківника,
- збільшення кишкової проникненості,
- вплив на стимуляцію вродженого і набутого імунітету.
2. «Молекулярна мімікрія» між білками вірусів, бактерій або кандид та гліадином:
- Ротавірус (тригер аутоімунного запалення (Ig А до tTG2) та збільшення кишкової проникненості внаслідок ентериту),
- Candida albicans (стимулювання синтезу Ig А до tTG2).
Целіакію поділяють на:
- Класичну
- Некласичну
- Безсимптомну
- Потенційну
- Рефрактерну
- Серонегативну
Прояви класичної целіакії:
- Втрата ваги
- Затримка зросту
- Затримка статевого розвитку
- Блювота
- Хронічна діарея
- Розтягнення живота внаслідок метеоризму
- Залізодефіцитна анемія
- Зниження м’язової маси
- Набряки внаслідок гіпопротеінемії
- Роздратованість та депресивний настрій
Прояви некласичної целіакії:
- Абдомінальний біль
- Целіакійний криз (холероподібний синдром)
- Хронічна втома
- Хронічний закреп у дітей
- Диспепсія, рання насичуваність, анорексія
- Головний біль, хронічна мігрень
- Дерматологічні прояви (висипка, псоріаз, пухирці)
- Алопеція
- Периферійна нейропатія, атаксія
- Безпричинне підвищення АЛТ, АСТ
- Дефіцит фолієвої кислоти
- Дефіцит вітаміну B12
Можуть бути симптоми: зниження щільності кісток (остеопенія, остеопотроз), артрити, артралгії, безпричинне безпліддя, затримка пубертатного періоду, пізнє менархе/рання менопауза, безпричинні викидні, передчасні пологи або новонароджений меншого для строку розміру, дефекти зубної емалі, афтозний стоматит, депресія та тривожність, зміна настрою та роздратованість.
Прояви потенційної целіакії:
- є генетичний ризик (HLA-DQ2 /DQ8)
- є аутоантитіла до tТG та ЕМА
- при вживанні глютену не розвивається атрофія ворсинок тонкого кишківника, або її прояви незначні
Прояви рефрактерної целіакії:
- персистенція або рецидування клінічних симптомів та гістологічних змін СО тонкого кишківника протягом 12 місяців при дотриманні БГД. (СО-слизова оболонка, БГД- безглютенова дієта).
Виділяють певні причини персистенції симптомів целіакії: вживання прихованого глютену, помилковий діагноз целіакії, супутній СПК, лактазна недостатність, харчова алергія на інші продукти, панкреатична недостатність, мікроскопічний коліт, синдром надлишкового бактеріального росту, запальні захворювання кишківника, виразковий єюніт, Т-клітинна лімфома з ентеропатією.
Прояви серонегативної целіакії:
- відсутність специфічних серологічних маркерів
- наявність клінічних симптомів тяжкої мальабсорбції
- наявність атрофії ворсинок тонкого кишківника при біопсії
Діагностика
Для діагностики целіакії використовуються різні підходи (анамнез, клінічне обстеження, серологія, генетичне тестування, гістопатологічні дослідження), але жоден з них не може вважатися достатнім для встановлення діагнозу. Діагностика є достовірною лише при попередньому щоденному (впродовж ≥6-ти тиж.) споживанні ≥1-ї страви, що містить глютен (≈10 г глютену на день — стільки містять 4 скибки хліба).
Показання до серологічної діагностики:
- скринінгове дослідження у пацієнтів з підозрою на целіакію (відбір для біопсії тонкого кишківника);
- скринінгове дослідження у групах підвищенного ризику захворюваності на целіакію;
- оцінка дотримання безглютенової дієти.
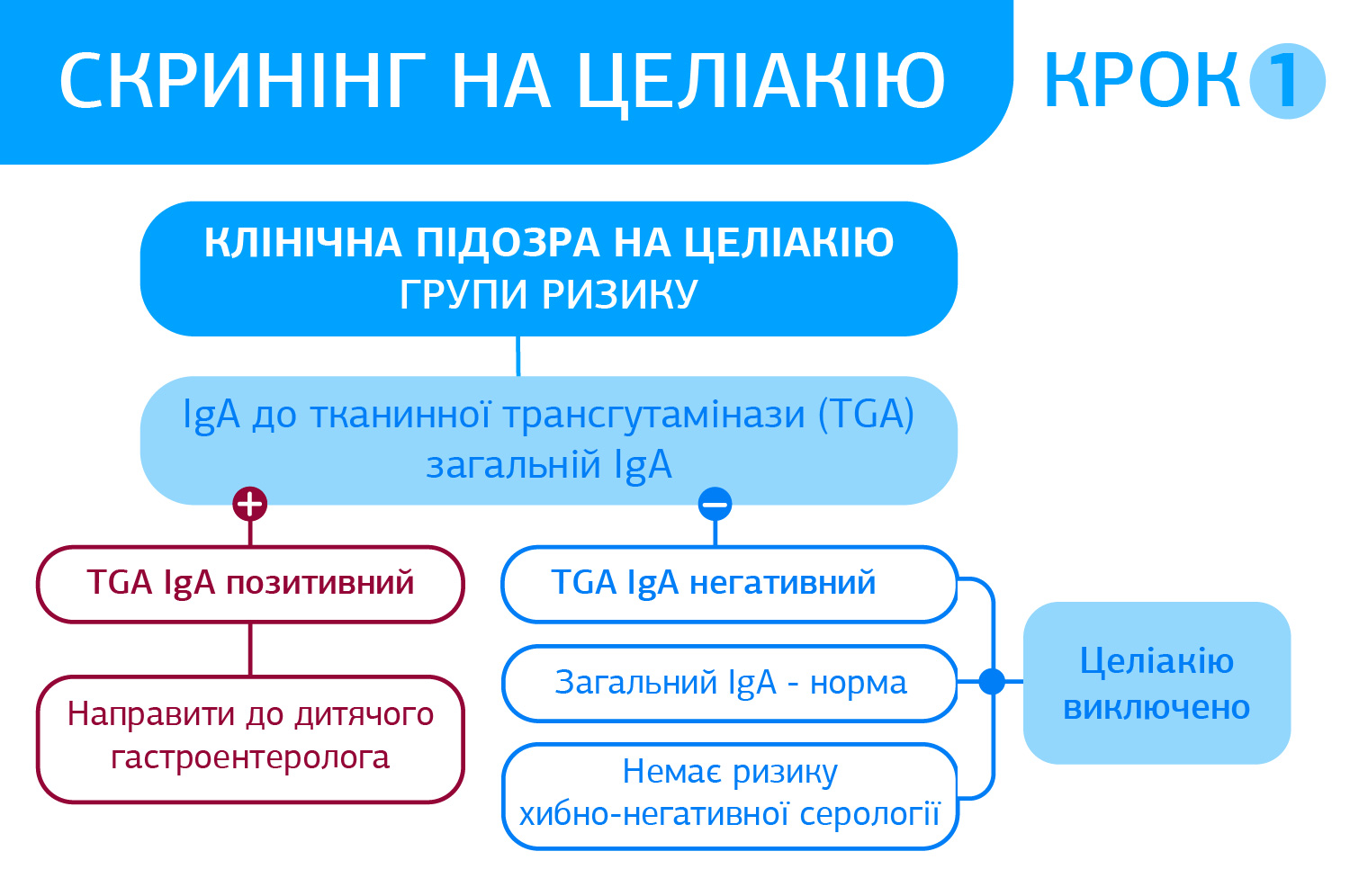
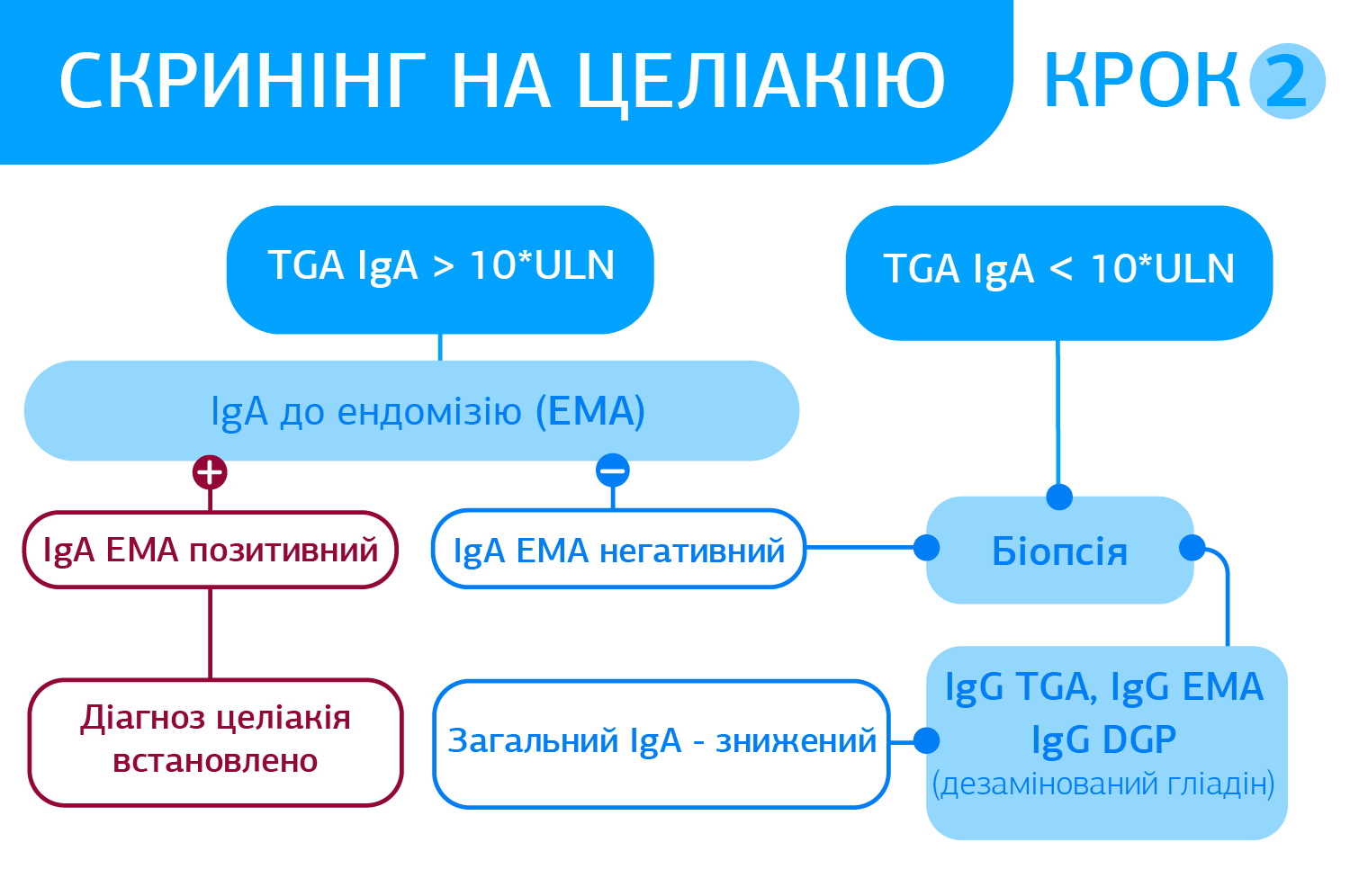
Алгоритм серологічної діагностики глютензалежних захворювань від ДІЛА базується на тестах ДРУГОГО ПОКОЛІННЯ, що відповідає світовим і Європейським тенденціям діагностики. Основні переваги діагностики Целіакії - специфічність та чутливість тестів EliA™ Celikey® і EliA™ Gliadin. (Див. нижче)


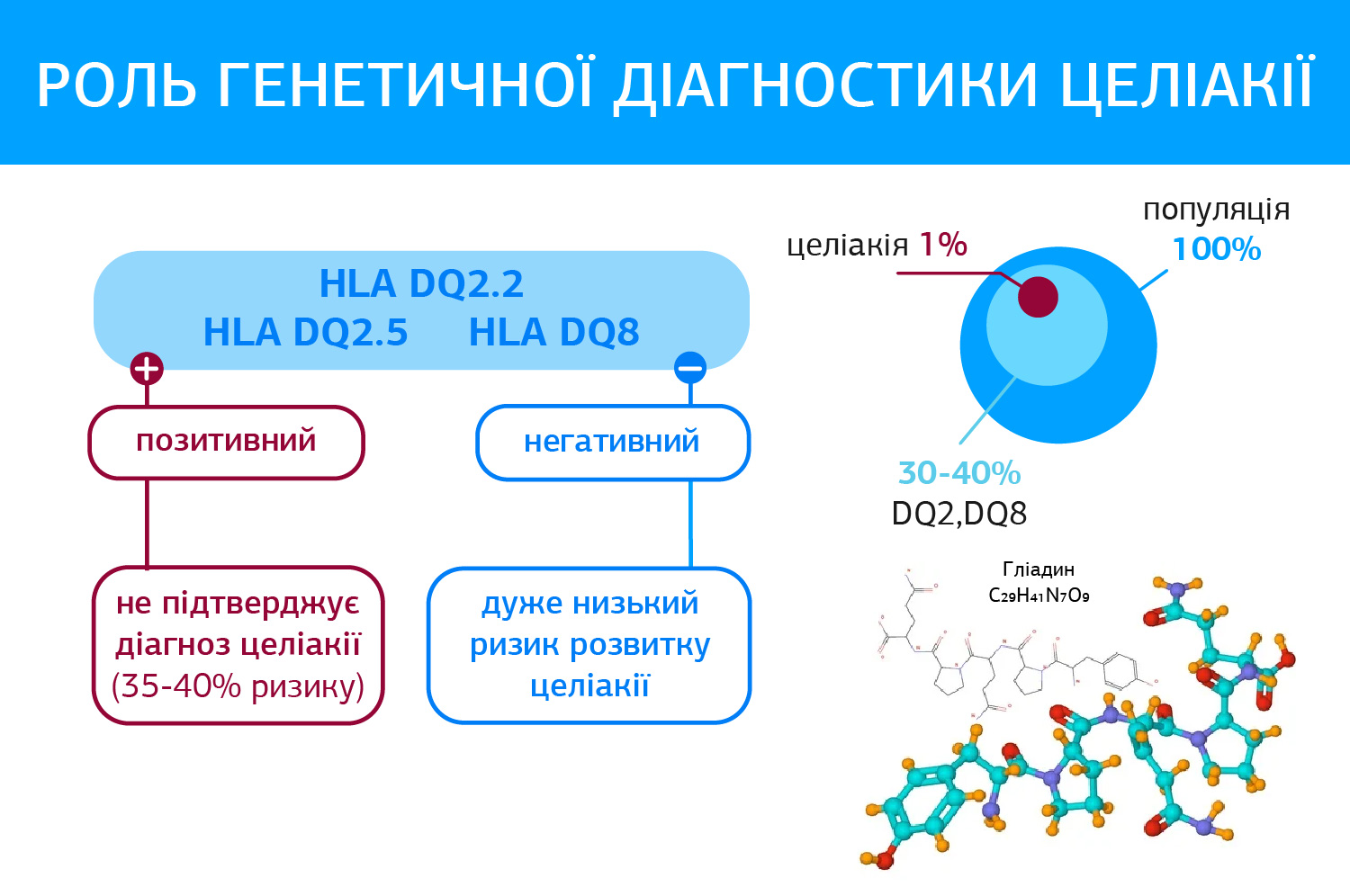
Роль генетичної діагностики целіакії:
Генетичні дослідження виключають, а не підтверджують діагноз, оскільки 35-40% популяції є носіями генів, які асоційовані з целіакією, згідно рекомендацій (Al-Toma A, Volta U, Auricchio R, et al. European Society for the Study of Coeliac Disease (ESsCD) guideline for coeliac disease and other gluten-related disorders. United European Gastroenterol J. 2019;7(5):583-613. doi:10.1177/2050640619844125). У пацієнтів з підтвердженою целіакією визначаються HLA-DQ2.5 – у 90-95%, а HLA-DQ2.2 та HLA-DQ8 – у 5-10%. Відсутність генотипів HLA-DQ2 або DQ8 виключає діагноз целіакії.
Таким чином:
- Тестування HLA-DQ2 / DQ8 не повинно використовуватись рутинно при первинній діагностиці целіакії (Сильна рекомендація, середній рівень доказовості)
- Тестування HLA-DQ2 / DQ8 необхідно проводити для виключення целіакії в окремих клінічних випадках:
- гістологія Марш 1-2 у серонегативних пацієнтів;
- у пацієнтів, яким призначена БГД без серологічного скринінгу на целіакію;
- у випадках, коли результати специфічної серології позитивні, а гістологічні ознаки целіакії відсутні (Сильна рекомендація, середній рівень доказовості).
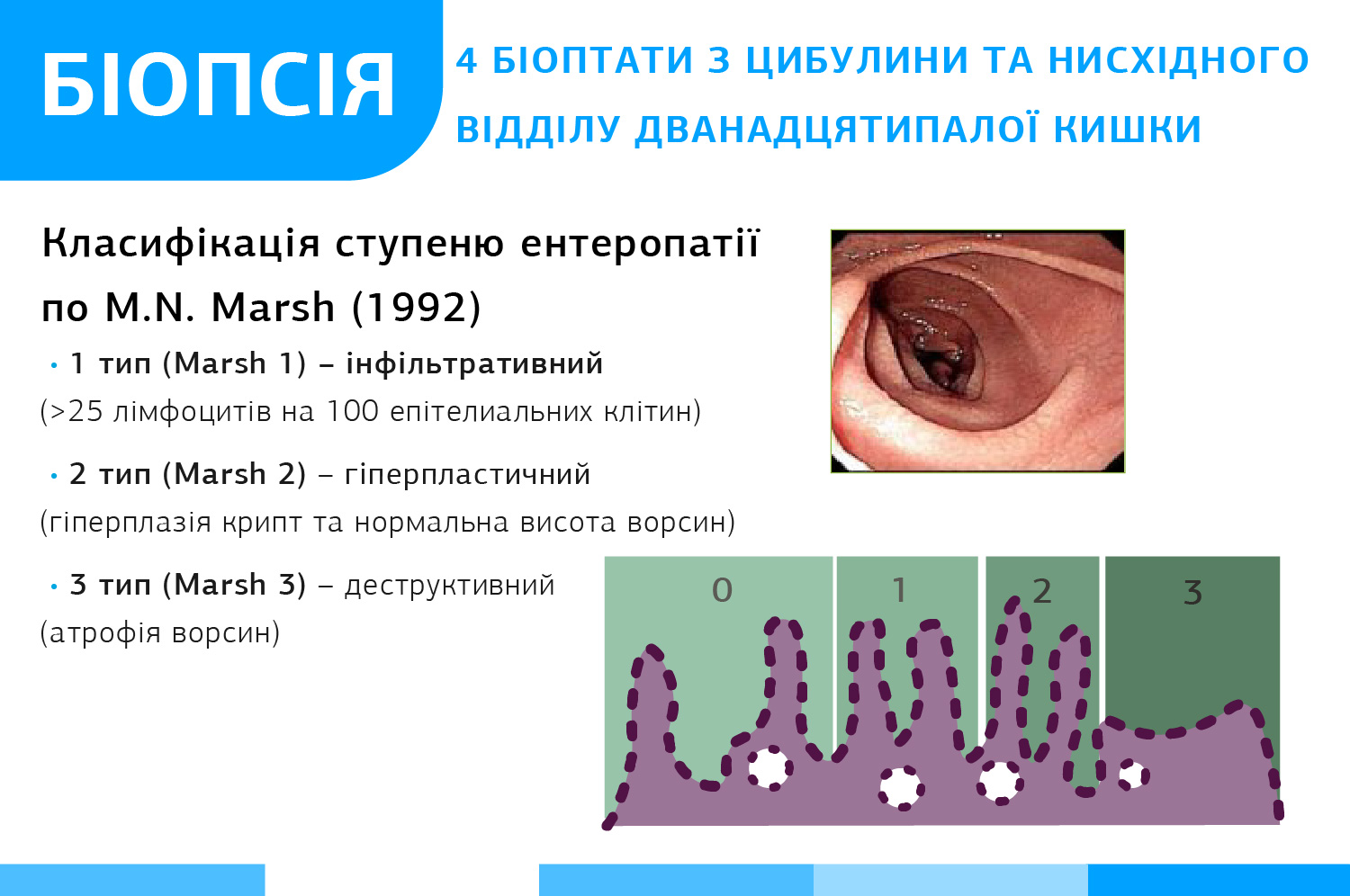
Гістологічне дослідження слизової оболонки тонкого кишківника у діагностиці целіакії має основне значення. Забір біоптатів проводять з дванадцятипалої кишки (1-2 з цибулини та ≥4-х з позацибулинного відділу). Характерною гістологічною ознакою є атрофія кишкових ворсинок, яку супроводжує збільшення кількості ендоепітеліальних лімфоцитів і гіпертрофія крипт.
Зазначені певні кроки діагностики Целіакії у пацієнтів, які вже дотримуються БГД ( безглютенової дієти) Al-Toma A, Volta U, Auricchio R, et al. European Society for the Study of Coeliac Disease (ESsCD) guideline for coeliac disease and other gluten-related disorders. United European Gastroenterol J. 2019;7(5):583-613. doi:10.1177/2050640619844125:
- Серологічне тестування позитивне, наступний крок – БІОПСІЯ з тонкого кишківника.
- Серологічне тестування негативне, а генетичне (HLA DQ2/DQ8) позитивне – необхідно проводити пробу на глютен (Сильна рекомендація, високий рівень доказовості).
До ускладнень целіакії відносяться:
- рак (ризик знижується майже до нормальних показників через 5 років дотримання БГД)
- злоякісні лімфоми
- аденокарцинома тонкого кишківника
- орофарингеальні пухлини
- безпричинне безпліддя (12%)
- ураження кісток та порушення зросту (остеопороз 30–40%)
- переломи кісток (35% для пацієнтів з класичною целіакією)
- у дорослих підвищений ризик смерті
- патологічна вагітність та пологи
Прогноз при дотриманні пацієнтами пожиттєвої безглютенової дієти сприятливий: спостерігається значне покращення стану, зникнення симптомів та підвищення якості життя, також знижується ризик, як доброякісних, так і злоякісних ускладнень.
Які лікарські помилки мають місце при постановці діагнозу целіакія?
Лікар для діагностики целіакії призначив обстеження:
- після початку безглютенової дієти
- тільки Ig G/A до гліадину
- без урахування імунодефіцитних станів
- генетичну діагностику для підтвердження діагнозу
- біопсію без серологічної діагностики
При диференційній діагностиці глютенової хвороби (целіакії) потрібно виключити певну патологію ШКТ, а саме: виразкову хворобу шлунку та 12-типалої кишки, хронічний гастрит асоційований з Хелікобактер пілорі, атрофічний гастрит, порушення всмоктування (мальабсорбції), вітамінів, мікроелементів, пов’язане з захворюваннями шлунку. Для такої дифдіагностики ДІЛА пропонує «Гастрокомплекс» – комплексне дослідження крові, що включає такі маркери як:
- пепсиноген I та II,
- співвідношення пепсиноген I до пепсиноген II,
- гастрин-17 кількісн.,
- Хелікобактеріоз,
- Helicobacter pylori,
- антитіла IgG.
Вимірювання концентрацій перерахованих вище біомаркерів дозволяє лікарю провести непряму оцінку стану слизової оболонки шлунку і спланувати подальші кроки. На підставі отриманих результатів всіх пацієнтів з диспепсією поділяють на три групи:
- Пацієнти з нормальною слизовою оболонкою шлунку
- Пацієнти з Хелікобактеріозом без атрофічного гастриту
- Пацієнти з атрофічним гастритом
Дослідження використовується з метою оцінки стану слизової оболонки шлунку:
- Як безпечний неінвазивний метод діагностики, що дозволяє виявити причину диспепсичних розладів (нудота, печія, біль у шлунку);
- Високоспецифічний первісний метод діагностики для пацієнтів із протипоказаннями до інструментальних методів обстеження (ЕФГДС та ін.);
- Оптимальний скринінговий метод оцінки слизової оболонки шлунку та раннього виявлення атрофічного гастриту;
- Для додаткової інформації лікарю-ендоскопісту при діагностиці передракових змін слизової шлунка
Важливо знати, що Гастрокомплекс– це непрямий метод оцінки стану слизової оболонки шлунку, який не може повністю замінити гастроскопію.
При підготовці до дослідження необхідно враховувати прийом інгібіторів протонної помпи – пантопразолу, омепразолу та ін., антацидів, Н2- блокаторів.
Використані джерела:
- Niland B., Cash B.D. Health benefits and adverse effects of a gluten-free diet in non-celiac disease patients. Gastroenterol Hepatol (NY) 2018; 14: 82-91.
- Golley S., Corsini N., Topping D. et al. Motivations for avoiding wheat consumption in Australia: results from a population survey. Public Health Nutr 2015; 18: 490-499.
- ESPGHAN Guidelines for Diagnosing Coeliac Disease, 2019,2020
- Lebwohl B., Sanders D.S., Green P.H.R. Coeliac disease. Lancet 2018; 391: 70-81.
- Catassi C., Alaedini A., Bojarski C. et al. The overlapping area of non-celiac gluten sensitivity (NCGS) and wheat-sensitive irritable bowel syndrome (IBS): an update. Nutrients 2017; 9:pii: E1268.
- Tanpowpong P., Ingham T.R., Lampshire P.K. et al. Coeliac disease and gluten avoidance in New Zealand children. Arch Dis Child 2012; 97: 12-16.
- Aziz I., Lewis N.R., Hadjivassiliou M. et al. A UK study assessing the population prevalence of self-reported gluten sensitivity and referral characteristics to secondary care. Eur J Gastroenterol Hepatol 2014; 26: 33-39.
- Carroccio A., Giambalvo O., Blasca F. et al. Self-reported non-celiac wheat sensitivity in high school students: demographic and clinical characteristics. Nutrients 2017; 9: pii: E771.
- Volta U., Tovoli F., Cicola R. et al. Serological tests in gluten sensitivity (nonceliac gluten intolerance). J Clin Gastroenterol 2012; 46: 680-685.
- Carroccio A., Mansueto P., Iacono G. et al. Nonceliac wheat sensitivity diagnosed by double-blind placebo-controlled challenge: exploring a new clinical entity. Am J Gastroenterol 2012; 107: 1898-1906.
- Lovell R.M., Ford A.C. Global prevalence of and risk factors for irritable bowel syndrome: a meta-analysis. Clin Gastroenterol Hepatol 2012; 10: 712-721.
- Carroccio A., Mansueto P., D’Alcamo A., Iacono G. Nonceliac wheat sensitivity as an allergic condition: personal experience and narrative review. Am J Gastroenterol 2013; 108: 1845-1852.
- Hollon J., Puppa E.L., Greenwald B. et al. Effect of gliadin on permeability of intestinal biopsy explants from celiac disease patients and patients with nonceliac gluten sensitivity. Nutrients 2015; 7: 1565-1576.
- Sapone A., Lammers K.M., Casolaro V. et al. Divergence of gut permeability and mucosal immune gene expression in two gluten-associated conditions: celiac disease and gluten sensitivity. BMC Med 2011; 9: 23.
- Portincasa P., Bonfrate L., de Bari O. et al. Irritable bowel syndrome and diet. Gastroenterol Rep (Oxf) 2017; 5: 11-19.
- Vazquez-Roque M.I., Camilleri M., Smyrk T. et al. A controlled trial of gluten-free diet in patients with irritable bowel syndrome-diarrhea: effects on bowel frequency and intestinal function. Gastroenterology 2013; 144: 903.e3-911.e3.
- Wu R.L., Vazquez-Roque M.I., Carlson P. et al. Gluten-induced symptoms in diarrhea-predominant irritable bowel syndrome are associated with increased myosin light chain kinase activity and claudin-15 expression. Lab Invest 2017; 97: 14-23.
- Fritscher-Ravens A., Schuppan D., Ellrichmann M. et al. Confocal endomicroscopy shows food-associated changes in the intestinal mucosa of patients with irritable bowel syndrome. Gastroenterology 2014; 147: 1012.e4-1020.e4.
- Schuppan D., Zevallos V. Wheat amylase trypsin inhibitors as nutritional activators of innate immunity. Dig Dis 2015; 33: 260-263.
- Reig-Otero Y., Manes J., Manyes L. Amylase-trypsin inhibitors in wheat and other cereals as potential activators of the effects of nonceliac gluten sensitivity. J Med Food 2018; 21: 207-214.
- Gomez L., Martin E, Hernandez D. et al. Members of the alpha-amylase inhibitors family from wheat endosperm are major allergens associated with baker’s asthma. FEBS Lett 1990; 261: 85-88.
- Junker Y., Zeissig S., Kim S.J. et al. Wheat amylase trypsin inhibitors drive intestinal inflammation via activation of toll-like receptor 4. J Exp Med 2012; 209: 2395-2408.
- de Punder K., Pruimboom L. The dietary intake of wheat and other cereal grains and their role in inflammation. Nutrients 2013; 5: 771-787.
- Murray K., Wilkinson-Smith V., Hoad C. et al. Differential effects of FODMAPs (fermentable oligo-, di-, mono-saccharides and polyols) on small and large intestinal contents in healthy subjects shown by MRI. Am J Gastroenterol 2014; 109: 110-119.
- Spiller R. How do FODMAPs work? J Gastroenterol Hepatol 2017; 32 Suppl 1: 36-39.
- Catassi C., Elli L., Bonaz B. et al. Diagnosis of non-celiac gluten sensitivity (NCGS): the Salerno Experts’ Criteria. Nutrients 2015; 7: 4966-4977.















