Глютен-залежні захворювання: що робити лікареві при сумнівних серологічних текстах?
04.05.2023
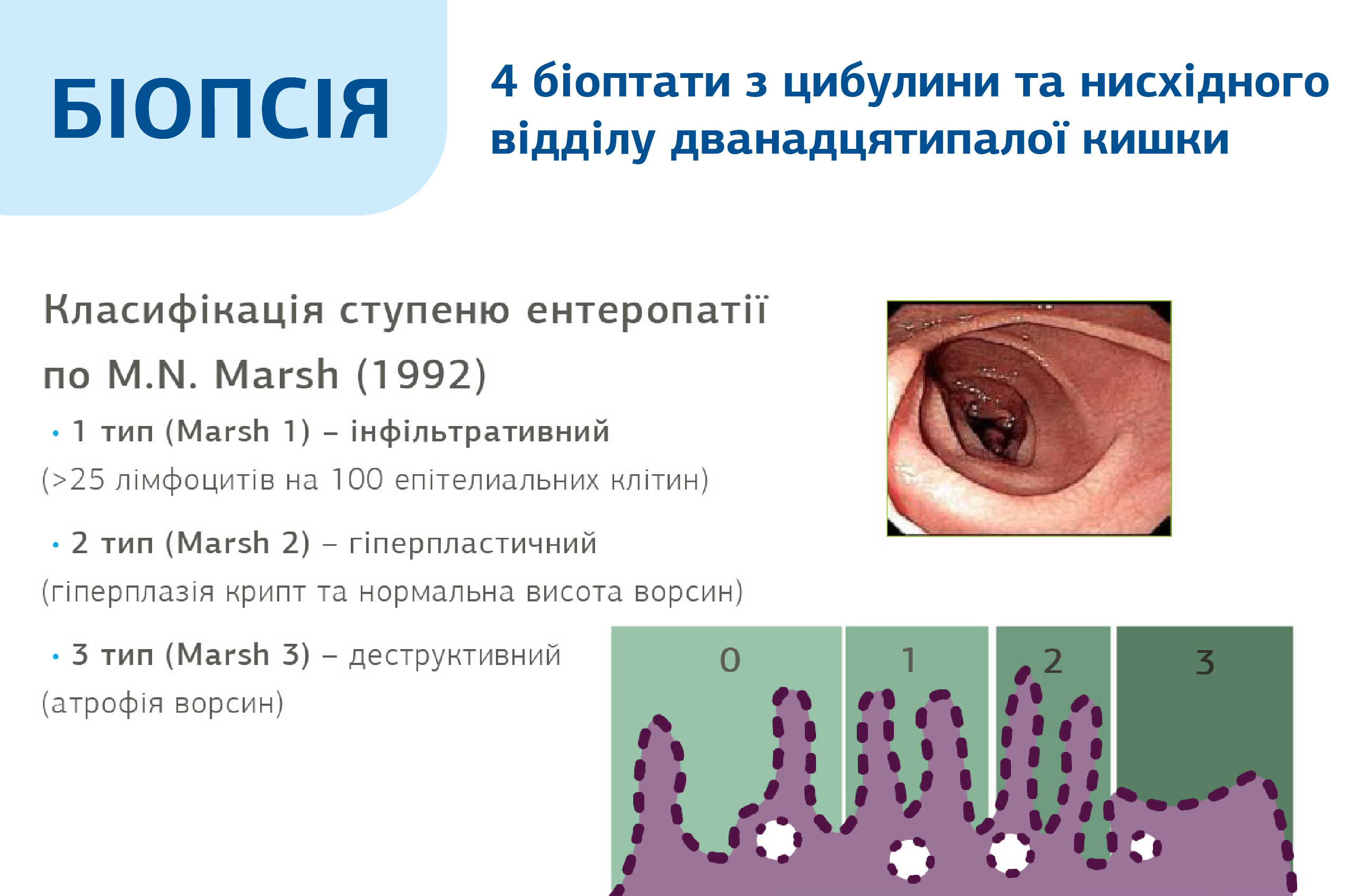
При сумнівних серологічних тестах, наступним важливим діагностичним етапом є біопсія слизової оболонки тонкої кишки (зацибулинних відділів дванадцятипалої кишки) з виявленням повної або практично повної атрофії ворсинок слизової оболонки тонкої кишки. Забір біоптатів проводять з дванадцятипалої кишки (1-2 з цибулини та ≥4-х з позацибулинного відділу). Характерною гістологічною ознакою є атрофія кишкових ворсинок, яку супроводжує збільшення кількості ендоепітеліальних лімфоцитів і гіпертрофія крипт . Гістологічне дослідження слизової оболонки тонкого кишківника у діагностиці целіакії має основне значення.
Вирішальну роль у запуску аутоімунного процесу відіграють також гени HLA-DQ2 та/або HLA-DQ8, які активують продукцію антитіл до тканинної трансглутамінази, ендомізію, дезамінованих пептидів гліадину. Відповідно до European Society for the Study of Coeliac Disease (ESsCD) генетичне тестування використовують як метод виключення:
1.Тестування HLA-DQ2 / DQ8 не повинно використовуватись рутинно при первинній діагностиці целіакії (Сильна рекомендація, середній рівень доказовості)
2. Тестування HLA-DQ2 / DQ8 необхідно проводити для виключення целіакії в окремих клінічних випадках:
- гістологія Марш 1-2 у серонегативних пацієнтів;
- у пацієнтів, яким призначена БГД без серологічного скринінгу на целіакію;
- у випадках, коли результати специфічної серології позитивні, а гістологічні ознаки целіакії відсутні. (Сильна рекомендація, середній рівень доказовості)
Al-Toma A, Volta U, Auricchio R, et al. European Society for the Study of Coeliac Disease (ESsCD) guideline for coeliac disease and other gluten-related disorders. United European Gastroenterol J. 2019;7(5):583-613. doi:10.1177/2050640619844125

Також потрібно провести диференційну діагностику з іншими патологіями ШКТ, при яких можлива атрофія та/або лімфоцитарна інфільтрація слизової оболонки тонкого кишківника, а саме:
- Кишкові інфекції, лямбліоз
- Аутоімунна ентеропатія
- Еозинофільний гастроентерит
- Ентеропатії при імунодефіцитних станах, ВІЛ-ентеропатія
- Медикаментозна ентеропатія (антагоністи рецепторів ангіотензину 1, сартани, нестероїдні протизапальні)
- Т-клітинна лімфома
- Запальні захворювання кишечника
- Тропічний спру
- Хвороба Уіппла
- Синдром надлишкового бактеріального росту ( СНБР)
- Нр- інфекція (виразкова хвороба, хр. гастродуоденіт)
- Харчова гіперчутливість (непереносимість)
Для диференційної діагностики з захворюваннями шлунку ДІЛА пропонує «Гастрокомплекс» – комплексне дослідження по крові, що включає такі маркери як:
- пепсиноген I та II,
- співвідношення пепсиноген I до пепсиноген II,
- гастрин-17 кількісн.,
- Хелікобактеріоз, Helicobacter pylori, антитіла IgG.
Вимірювання концентрацій перерахованих вище біомаркерів дозволяє лікарю провести непряму оцінку стану слизової оболонки шлунку і спланувати подальші кроки. На підставі отриманих результатів всіх пацієнтів з диспепсією поділяють на три групи:
- Пацієнти з нормальною слизовою оболонкою шлунку
- Пацієнти з Хелікобактеріозом без атрофічного гастриту
- Пацієнти з атрофічним гастритом
Гастрокомплекс призначається:
- Як безпечний неінвазивний метод діагностики , що дозволяє виявити причину диспепсичних розладів (нудота, печія, біль у шлунку);
- Високоспецифічний первісний метод діагностики для пацієнтів із протипоказаннями до інструментальних методів обстеження (ЕФГДС);
- Оптимальний скринінговий метод оцінки слизової оболонки шлунку та раннього виявлення атрофічного гастриту;
- Для додаткової інформації лікарю-ендоскопісту при діагностиці передракових змін слизової шлунка
На допомогу до бланку результату додається таблиця з клінічною інтерпретацією отриманих результатів.

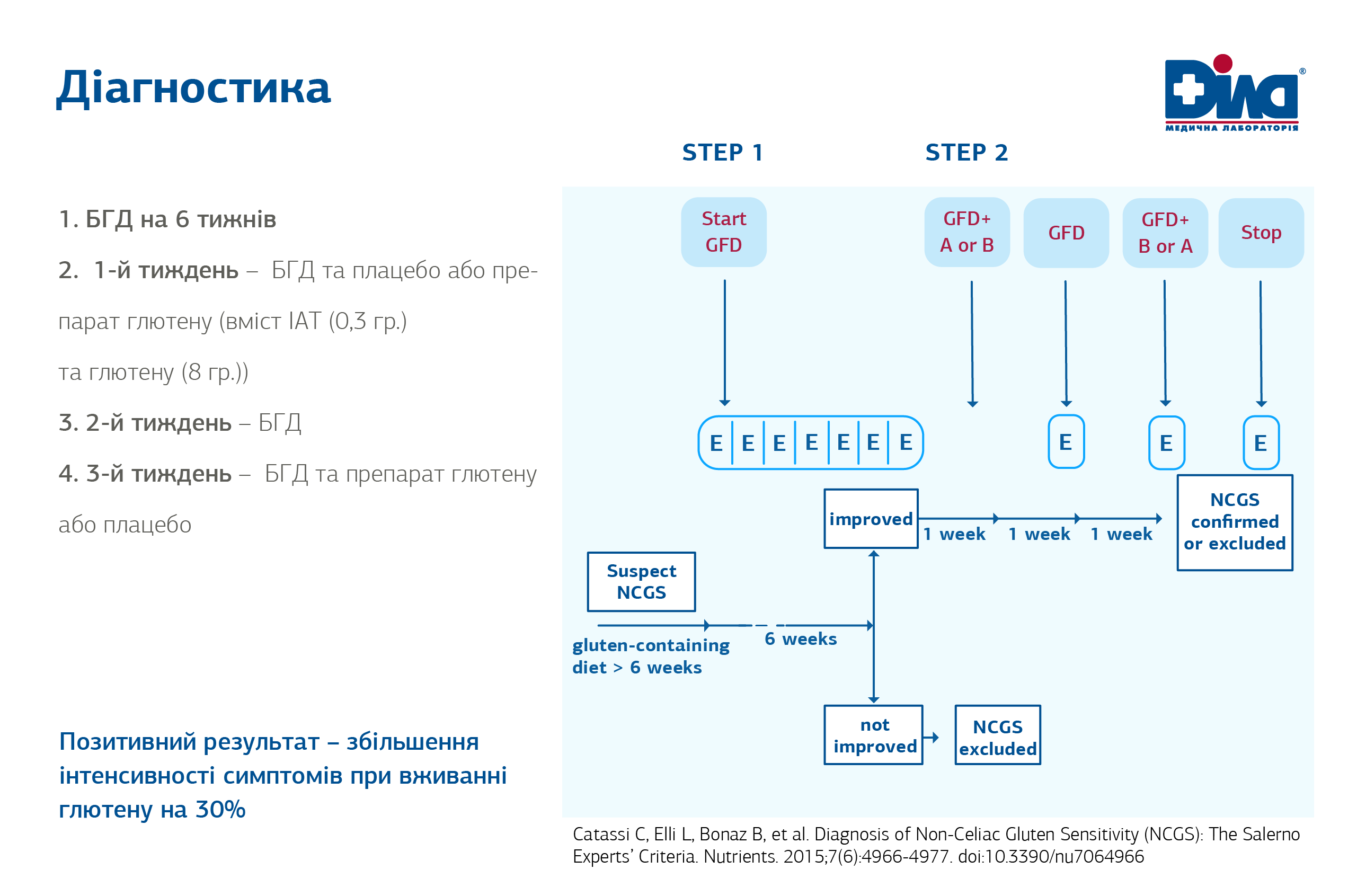
Пацієнтам, що дотримуються БГД (безглютенової дієти) рекомендовані наступні кроки з діагностики Целіакії Al-Toma A, Volta U, Auricchio R, et al. European Society for the Study of Coeliac Disease (ESsCD) guideline for coeliac disease and other gluten-related disorders. United European Gastroenterol J. 2019;7(5):583-613. doi:10.1177/2050640619844125:
- Серологічне тестування позитивне, наступний крок – БІОПСІЯ з тонкого кишківника.
- Серологічне тестування негативне, а генетичне (HLA DQ2/DQ8) позитивне – необхідно проводити пробу на глютен -2 тижня (3,5-7 г глютену діти, дорослі-10-12 г)- (Сильна рекомендація, високий рівень доказовості).
Після скринінгу на целіакію, проводиться диференційна діагностика з іншими глютен-залежними захворюваннями.
1.Діагностика алергії на пшеницю:
- Специфічні IgE до пептидів пшениці (Immuno CAP), а саме : маркери важких алергічних реакцій при вживанні пшениці:
rTri a 14 (білки-переносники ліпідів (LTP)) – потрапляють з їжею, при вдиханні або контакті зі шкірою
rTri a 19 (ω 5-гліадин) - негайна IgE-реакція на пшеницю та фактор ризику розвитку анафілаксії, пов’язаної з фізичним навантаженням, після вживання пшениці (WDEIA).
rTri a 12 (профіліни) - перехресна реактивність з пилком рослин та трав
rTri a aA_TI (Інгібітор α-амілази та трипсину) - спричинює «астму пекарів» (не має перехресту з пилком трав)
- Позитивний шкірний прик-тест з екстрактом пшениці - має обмежену інформативність через відсутність в екстрактах спирторозчинних компонентів (гліадину), часто дає хибно-позитивні результати через сенсибілізацію до профілінів (перехресна реактивність з пилком).
2. Діагностика чутливості до глютену без целіакії. Провокативно- елімінаційна проба.
Провокації глютеном потребують пацієнти, які вже знаходяться на GFD ( БГД)-дієті і добре на неї реагують. Відповідно до Рекомендацій, для провокації у дорослих застосовують звичайний хліб, у дітей – поступове додавання глютену (аби дитина не відчувала смак випічки).
Лікарські помилки, що мають місце при діагностиці глютен-залежних захворювань, на які потрібно звернути увагу:
- Призначення БГД до проведення серологічного обстеження для виключення целіакії!
- Діагностика ЧГБЦ та призначення БГД на підставі позитивного тесту на IgG до гліадіну (AGA) без визначення IgА (або IgG при дефіциті загального IgА) TGA та ЕМА для виключення целіакії!
- Діагностика целіакії на підставі позитивного генетичного обстеження (HLA-DQ2/DQ8 ) без специфічних серологічних тестів!
- Діагностика целіакії на підставі гістологічних змін (Марш1-3) без підтвердження специфічними серологічними тестами!
- Діагностика ЧГБЦ та призначення БГД без попереднього виключення целіакії та алергії на пептиди пшениці!
Отже, незважаючи на схожість симптоматики глютен-залежних захворювань, вони мають різний перебіг. Чутливість до глютену проявляється менш агресивними симптомами, ніж целіакія, адже не має сильної спадкової основи. Для целіакії існують чіткі лабораторні маркери, за якими лікар може встановити діагноз, так само і для алергії на пшеницю, а от для чутливості до глютену без целіакії ЧГБЦ такого тесту немає.
Лікування глютен-залежних захворювань пов’язано з дотриманням безглютенової дієти. Для целіакії це пожиттєва дієта, для ЧГБЦ і алергії на пшеницю можливе формування толерантності з віком.
Використана література:
- Al-Toma A, Volta U, Auricchio R, et al. European Society for the Study of Coeliac Disease (ESsCD) guideline for coeliac disease and other gluten-related disorders. United European Gastroenterol J. 2019;7(5):583-613. doi:10.1177/2050640619844125Niland B., Cash B.D. Health benefits and adverse effects of a gluten-free diet in non-celiac disease patients. Gastroenterol Hepatol (NY) 2018; 14: 82-91.
- Al-Toma A, Volta U, Auricchio R, et al. European Society for the Study of Coeliac Disease (ESsCD) guideline for coeliac disease and other gluten-related disorders. United European Gastroenterol J. 2019;7(5):583-613. doi:10.1177/2050640619844125
- Golley S., Corsini N., Topping D. et al. Motivations for avoiding wheat consumption in Australia: results from a population survey. Public Health Nutr 2015; 18: 490-499.
- ESPGHAN Guidelines for Diagnosing Coeliac Disease, 2019,2020
- Catassi C, Elli L, Bonaz B, et al. Diagnosis of Non-Celiac Gluten Sensitivity (NCGS): The Salerno Experts’ Criteria. Nutrients. 2015;7(6):4966-4977. doi:10.3390/nu7064966
- Sharma N, Bhatia S, Chunduri V, et al. Pathogenesis of Celiac Disease and Other Gluten Related Disorders in Wheat and Strategies for Mitigating Them. Front Nutr. 2020;7:6. Published 2020 Feb 7. doi:10.3389/fnut.2020.00006
- http://www.espghan.org/fileadmin/user_upload/IBD/ESPGHAN_Celiac_Guidelines_2019.pdf
- Lebwohl B., Sanders D.S., Green P.H.R. Coeliac disease. Lancet 2018; 391: 70-81.
- Catassi C., Alaedini A., Bojarski C. et al. The overlapping area of non-celiac gluten sensitivity (NCGS) and wheat-sensitive irritable bowel syndrome (IBS): an update. Nutrients 2017; 9:pii: E1268.
- Tanpowpong P., Ingham T.R., Lampshire P.K. et al. Coeliac disease and gluten avoidance in New Zealand children. Arch Dis Child 2012; 97: 12-16.
- Aziz I., Lewis N.R., Hadjivassiliou M. et al. A UK study assessing the population prevalence of self-reported gluten sensitivity and referral characteristics to secondary care. Eur J Gastroenterol Hepatol 2014; 26: 33-39.
- Carroccio A., Giambalvo O., Blasca F. et al. Self-reported non-celiac wheat sensitivity in high school students: demographic and clinical characteristics. Nutrients 2017; 9: pii: E771.
- Volta U., Tovoli F., Cicola R. et al. Serological tests in gluten sensitivity (nonceliac gluten intolerance). J Clin Gastroenterol 2012; 46: 680-685.
- Carroccio A., Mansueto P., Iacono G. et al. Nonceliac wheat sensitivity diagnosed by double-blind placebo-controlled challenge: exploring a new clinical entity. Am J Gastroenterol 2012; 107: 1898-1906.
- Lovell R.M., Ford A.C. Global prevalence of and risk factors for irritable bowel syndrome: a meta-analysis. Clin Gastroenterol Hepatol 2012; 10: 712-721.
- Carroccio A., Mansueto P., D’Alcamo A., Iacono G. Nonceliac wheat sensitivity as an allergic condition: personal experience and narrative review. Am J Gastroenterol 2013; 108: 1845-1852.
- Hollon J., Puppa E.L., Greenwald B. et al. Effect of gliadin on permeability of intestinal biopsy explants from celiac disease patients and patients with nonceliac gluten sensitivity. Nutrients 2015; 7: 1565-1576.
- Sapone A., Lammers K.M., Casolaro V. et al. Divergence of gut permeability and mucosal immune gene expression in two gluten-associated conditions: celiac disease and gluten sensitivity. BMC Med 2011; 9: 23.
- Portincasa P., Bonfrate L., de Bari O. et al. Irritable bowel syndrome and diet. Gastroenterol Rep (Oxf) 2017; 5: 11-19.
- Vazquez-Roque M.I., Camilleri M., Smyrk T. et al. A controlled trial of gluten-free diet in patients with irritable bowel syndrome-diarrhea: effects on bowel frequency and intestinal function. Gastroenterology 2013; 144: 903.e3-911.e3.
- Wu R.L., Vazquez-Roque M.I., Carlson P. et al. Gluten-induced symptoms in diarrhea-predominant irritable bowel syndrome are associated with increased myosin light chain kinase activity and claudin-15 expression. Lab Invest 2017; 97: 14-23.
- Fritscher-Ravens A., Schuppan D., Ellrichmann M. et al. Confocal endomicroscopy shows food-associated changes in the intestinal mucosa of patients with irritable bowel syndrome. Gastroenterology 2014; 147: 1012.e4-1020.e4.
- Schuppan D., Zevallos V. Wheat amylase trypsin inhibitors as nutritional activators of innate immunity. Dig Dis 2015; 33: 260-263.
- Reig-Otero Y., Manes J., Manyes L. Amylase-trypsin inhibitors in wheat and other cereals as potential activators of the effects of nonceliac gluten sensitivity. J Med Food 2018; 21: 207-214.
- Gomez L., Martin E, Hernandez D. et al. Members of the alpha-amylase inhibitors family from wheat endosperm are major allergens associated with baker’s asthma. FEBS Lett 1990; 261: 85-88.
- Junker Y., Zeissig S., Kim S.J. et al. Wheat amylase trypsin inhibitors drive intestinal inflammation via activation of toll-like receptor 4. J Exp Med 2012; 209: 2395-2408.
- de Punder K., Pruimboom L. The dietary intake of wheat and other cereal grains and their role in inflammation. Nutrients 2013; 5: 771-787.
- Murray K., Wilkinson-Smith V., Hoad C. et al. Differential effects of FODMAPs (fermentable oligo-, di-, mono-saccharides and polyols) on small and large intestinal contents in healthy subjects shown by MRI. Am J Gastroenterol 2014; 109: 110-119.
- Spiller R. How do FODMAPs work? J Gastroenterol Hepatol 2017; 32 Suppl 1: 36-39.
- Catassi C., Elli L., Bonaz B. et al. Diagnosis of non-celiac gluten sensitivity (NCGS): the Salerno Experts’ Criteria. Nutrients 2015; 7: 4966-4977.
- https://www.vz.kiev.ua/neperenosymist-glyutenu-bez-tseliakiyi-yak-diagnostuvaty-i-likuvaty/ Непереносимість глютену без целіакії: як діагностувати і лікувати?
- ГЛЮТЕН-ЧУТЛИВА ЕНТЕРОПАТІЯ: СТАН ПРОБЛЕМИ НА СУЧАСНОМУ ЕТАПІ. Горобець А.О Національний медичний університет імені О.О. Богомольця, м. Київ,
- https://health-ua.com/article/41194-oberezhnoglyuten--sho-neobhdno-znati-pro-tcelakyu














