Глютен-зависимые заболевания: что делать врачу при сомнительных серологических текстах?
04.05.2023
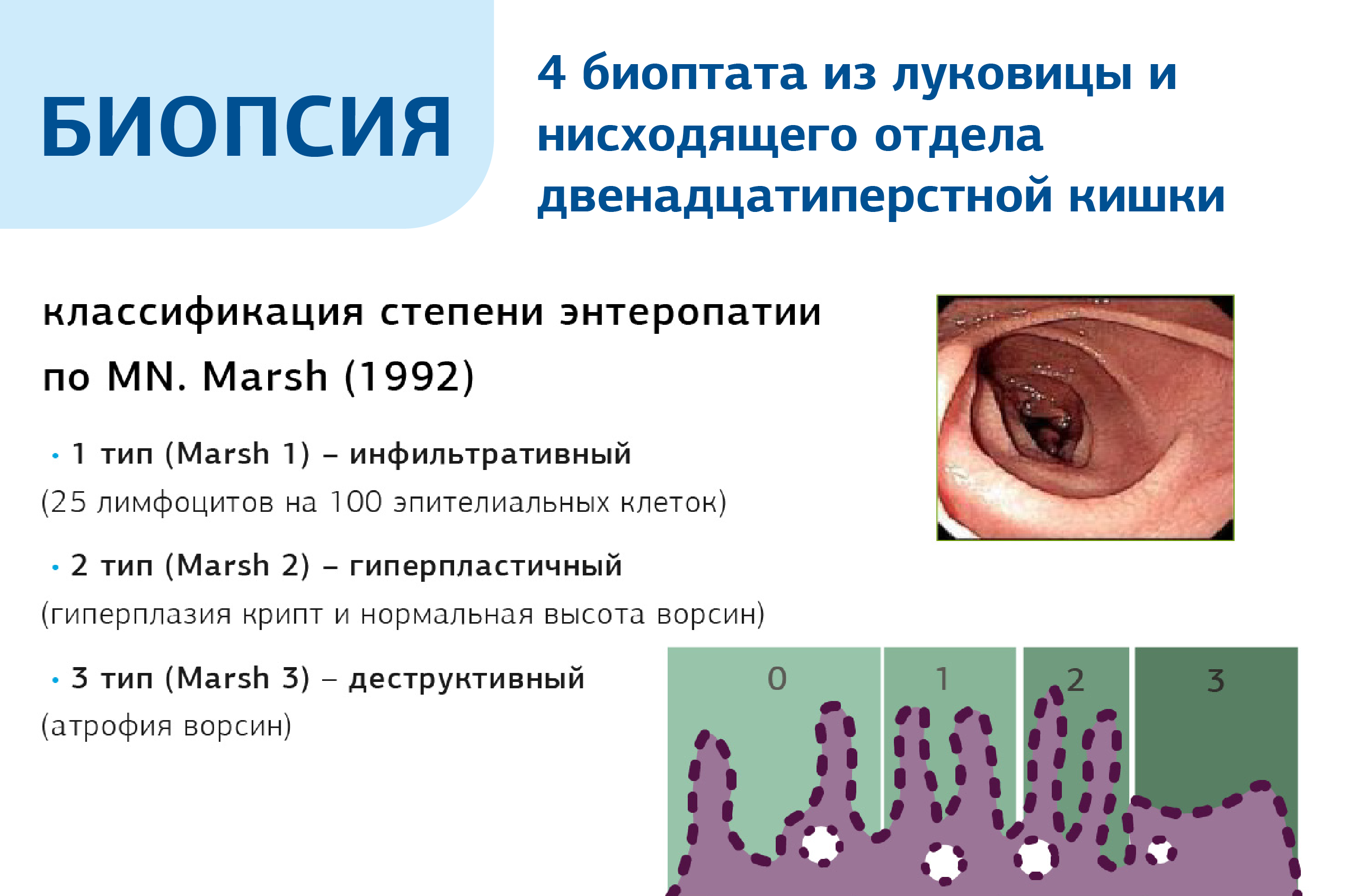
При сомнительных серологических тестах, следующим важным диагностическим этапом является биопсия слизистой тонкой кишки (залуковичных отделов двенадцатиперстной кишки) с обнаружением полной или практически полной атрофии ворсинок слизистой тонкой кишки. Забор биоптатов проводят из двенадцатиперстной кишки (1-2 из луковицы и 4-х из внелукового отдела). Характерным гистологическим признаком является атрофия кишечных ворсинок, сопровождающаяся увеличением количества эндоэпителиальных лимфоцитов и гипертрофией крипт. Гистологическое исследование слизистой тонкого кишечника в диагностике целиакии имеет основное значение.
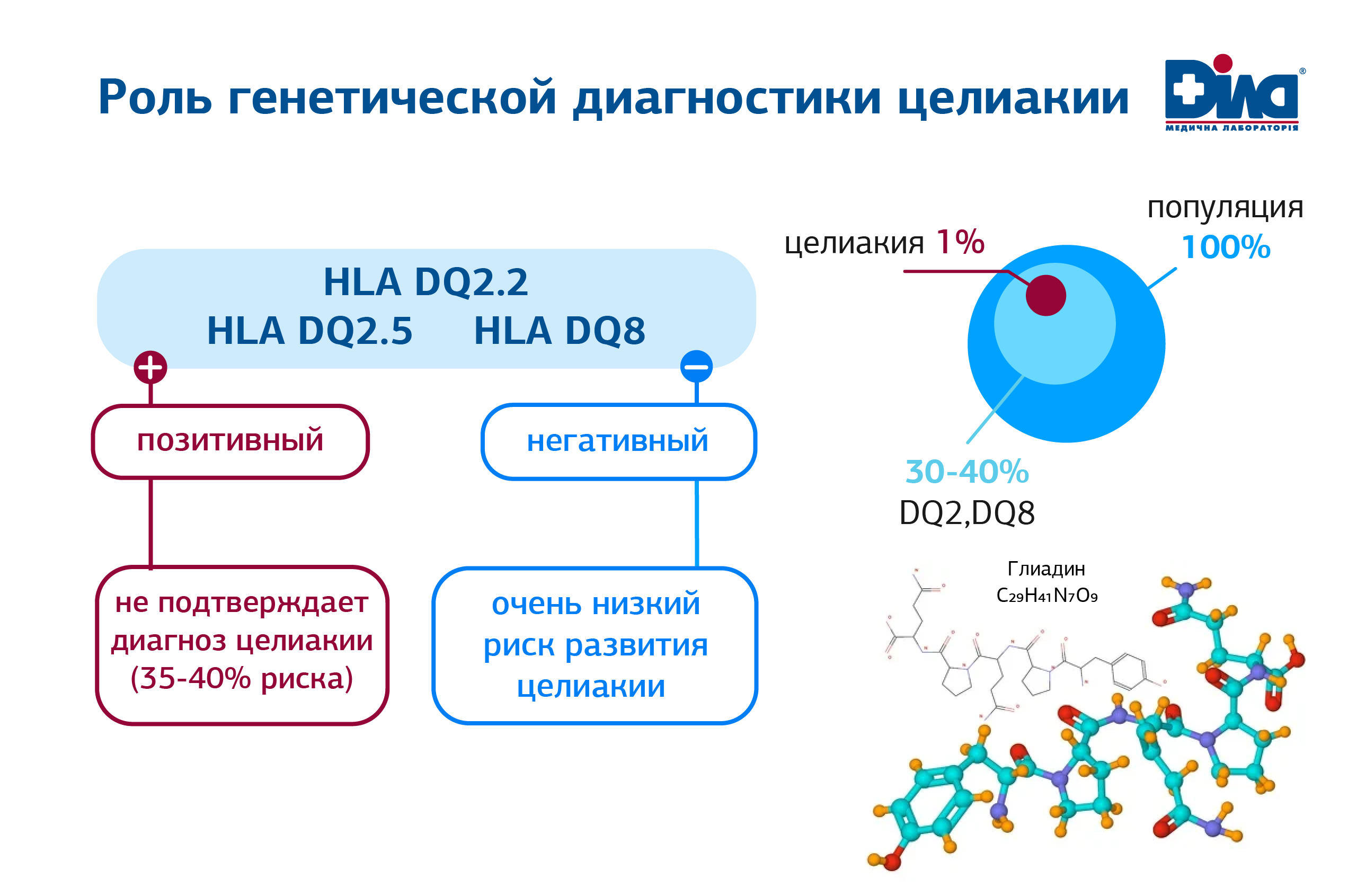
Решающую роль в запуске аутоиммунного процесса играют также гены HLA-DQ2 и/или HLA-DQ8, которые активируют продукцию антител к тканевой трансглутаминазе, эндомизии, дезаминированным пептидам глиадина. В соответствии с European Society for Study of Coeliac Disease (ESsCD) генетическое тестирование используют как метод исключения:
1.Тестирование HLA-DQ2/DQ8 не должно использоваться рутинно при первичной диагностике целиакии (Сильная рекомендация, средний уровень доказательности)
2. Тестирование HLA-DQ2/DQ8 необходимо проводить для исключения целиакии в отдельных клинических случаях:
- гистология Марш 1-2 у серонегативных пациентов;
- у пациентов, которым назначена БГД без серологического скрининга на целиакию;
- в случаях, когда результаты специфической серологии положительны, а гистологические признаки целиакии отсутствуют. (сильная рекомендация, средний уровень доказательности)
Al-Toma A, Volta U, Auricchio R, et al. European Society for Study of Coeliac disease (ESsCD) guideline для coeliac disease and other gluten-related disorders. United European Gastroenterol J. 2019; 7(5): 583-613. doi:10.1177/2050640619844125
Также нужно провести дифференциальную диагностику с другими патологиями ЖКТ, при которых возможна атрофия и/или лимфоцитарная инфильтрация слизистой тонкого кишечника, а именно:
- Кишечные инфекции, лямблиоз
- Аутоиммунная энтеропатия
- Эозинофильный гастроэнтерит
- Энтеропатия при иммунодефицитных состояниях, ВИЧ-энтеропатия
- Медикаментозная энтеропатия (антагонисты рецепторов ангиотензина 1, сартаны, нестероидные противовоспалительные)
- Т-клеточная лимфома
- Воспалительные заболевания кишечника
- Тропическую спру
- Болезнь Уиппла
- Синдром избыточного бактериального роста (СНБР)
- Нр-инфекция (язвенная болезнь, хр. Гастродуоденит)
- Пищевая гиперчувствительность (непереносимость)
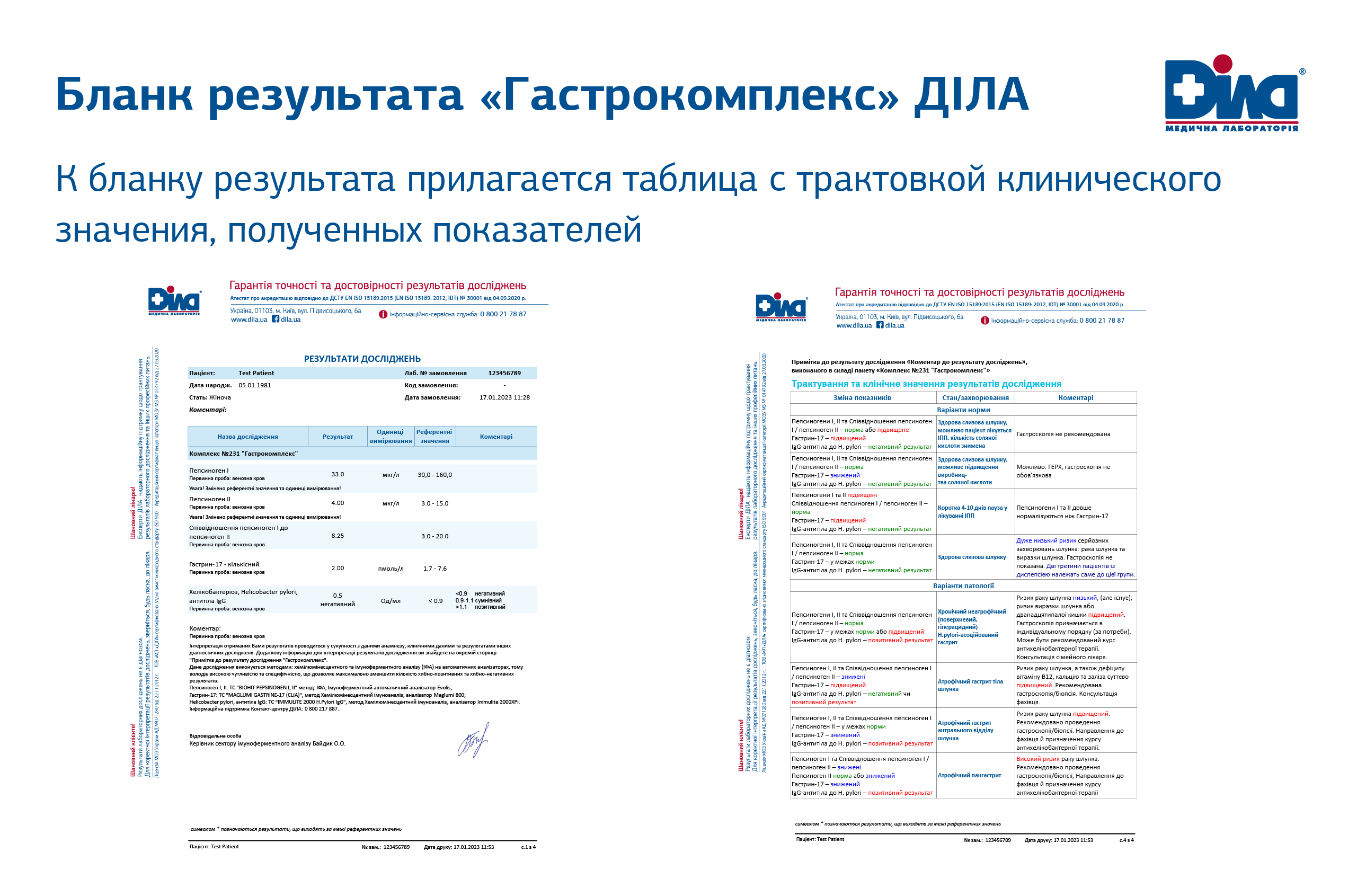
Для дифференциальной диагностики с заболеваниями желудка ДІЛА предлагает «Гастрокомплекс» – комплексное исследование крови, включающее такие маркеры как:
- пепсиноген I и II,
- соотношение пепсиноген I к пепсиноген II,
- гастрин-17 количествен.
- Хеликобактериоз, Helicobacter pylori, антитела IgG.
Измерение концентраций вышеперечисленных биомаркеров позволяет врачу провести косвенную оценку состояния слизистой желудка и спланировать дальнейшие шаги. На основании полученных результатов всех пациентов с диспепсией делят на три группы:
- Пациенты с нормальной слизистой желудка
- Пациенты с Хеликобактериозом без атрофического гастрита
- Пациенты с атрофическим гастритом
Гастрокомплекс назначается:
1. Как безопасный неинвазивный метод диагностики, позволяющий выявить причину диспепсических расстройств (тошнота, изжога, боль в желудке)
2. Высокоспецифический первоначальный метод диагностики для пациентов с противопоказаниями к инструментальным методам обследования (ЭФГДС)
3. Оптимальный скрининговый метод оценки слизистой желудка и раннего выявления атрофического гастрита
4. Для дополнительной информации врачу-эндоскописту при диагностике предраковых изменений слизистой желудка
В помощь в бланке результата прилагается таблица с клинической интерпретацией полученных результатов.
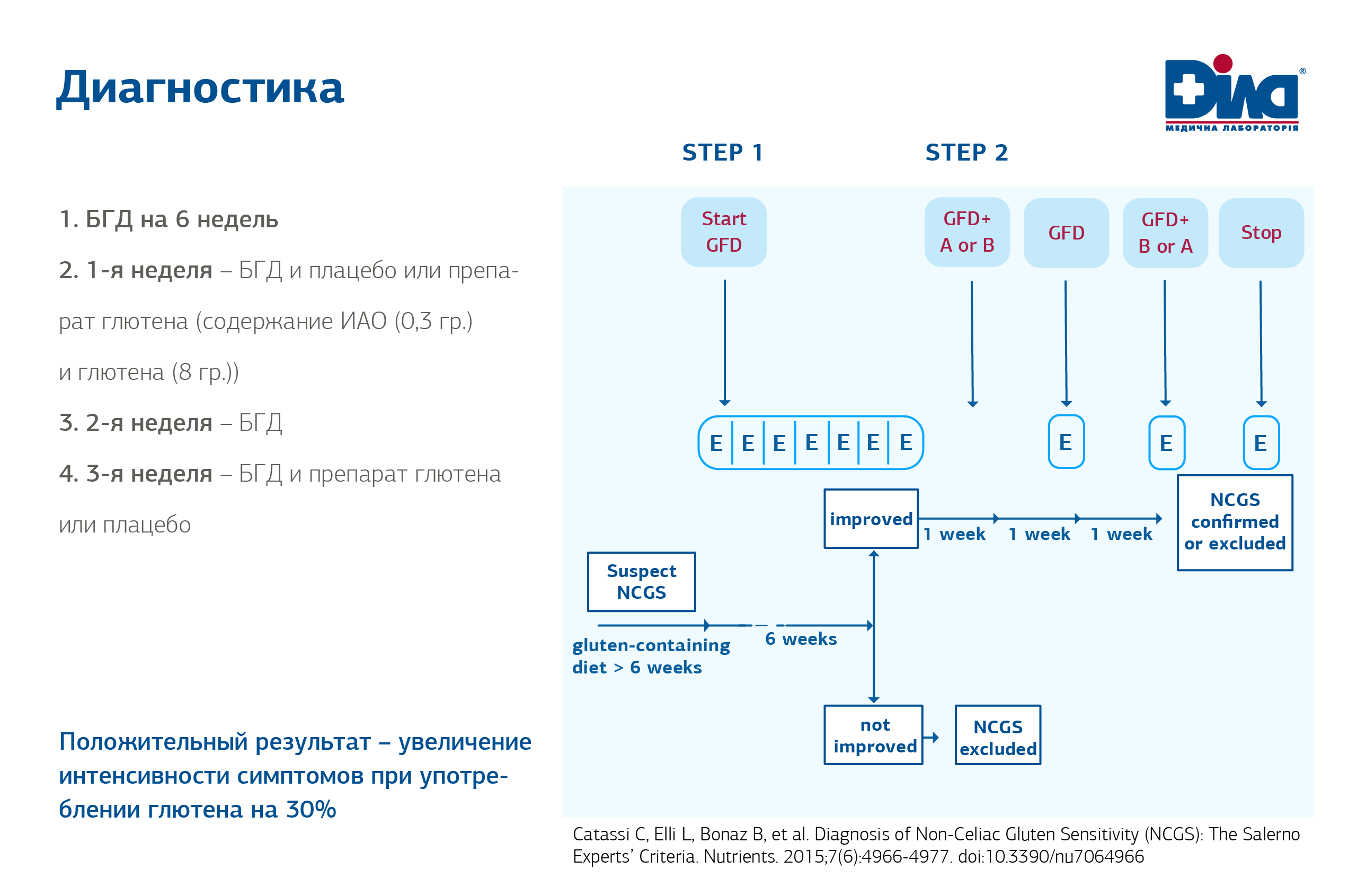
Пациентам, придерживающимся БГД (безглютеновой диеты), рекомендованы следующие шаги по диагностике Целиакии Al-Toma A, Volta U, Auricchio R, et al. European Society for Study of Coeliac disease (ESsCD) guideline для coeliac disease and other gluten-related disorders. United European Gastroenterol J. 2019; 7(5): 583-613. doi:10.1177/2050640619844125:
- Серологическое тестирование положительное, следующий шаг – биопсия из тонкого кишечника.
- Серологическое тестирование отрицательное, а генетическое (HLA DQ2/DQ8) положительное – необходимо проводить пробу на глютен -2 недели (3,5-7 г глютена дети, взрослые-10-12 г)- (сильная рекомендация, высокий уровень доказательности).
После скрининга на целиакию, проводится дифференциальная диагностика с другими глютензависимыми заболеваниями.
1. Диагностика аллергии на пшеницу:
Специфические IgE к пептидам пшеницы (Immuno CAP), а именно: маркеры тяжелых аллергических реакций при употреблении пшеницы:
- rTri a 14 (белки-переносчики липидов (LTP)) – попадают с пищей, при вдыхании или при контакте с кожей
- rTri a 19 (ω 5-глиадин) – немедленная IgE-реакция на пшеницу и фактор риска развития анафилаксии, связанной с физической нагрузкой, после употребления пшеницы (WDEIA).
- rTri a 12 (профилины) - перекрестная реактивность с пыльцой растений и трав
- rTri a aA_TI (Ингибитор α-амилазы и трипсина) - вызывает «астму пекарей» (не имеет перекрестка с пыльцой трав)
Положительный кожный прик-тест с экстрактом пшеницы - имеет ограниченную информативность из-за отсутствия в экстрактах спирторастворимых компонентов (глиадина), часто дает ложноположительные результаты из-за сенсибилизации к профилю (перекрестная реактивность с пыльцой).
2. Диагностика чувствительности к глютену без целиакии. Провокативно-элиминационная проба.
В провокации глютеном нуждаются пациенты, которые уже находятся на GFD (БГД) - диете и хорошо на нее реагируют. Согласно Рекомендациям, для провокации у взрослых применяют обычный хлеб, у детей – постепенное добавление глютена (чтобы ребенок не чувствовал вкус выпечки).
Врачебные ошибки, имеющие место при диагностике глютенозависимых заболеваний, на которые нужно обратить внимание:
- Назначение БГД для проведения серологического обследования для исключения целиакии!
- Диагностика ЧГБЦ и назначение БГД на основании положительного теста на IgG к глиадину (AGA) без определения IgА (или IgG при дефиците общего IgА) TGA и ЭМА для исключения целиакии!
- Диагностика целиакии на основании положительного генетического обследования (HLA-DQ2/DQ8) без специфических серологических тестов!
- Диагностика целиакии на основании гистологических изменений (Марш1-3) без подтверждения специфическими серологическими тестами!
- Диагностика ЧГБЦ и назначение БГД без предварительного исключения целиакии и аллергии на пептиды пшеницы!
Следовательно, несмотря на схожесть симптоматики глютен-зависимых заболеваний, они имеют разное течение. Чувствительность к глютену проявляется менее агрессивными симптомами, чем целиакия, ведь нет сильного наследственного основания. Для целиакии существуют четкие лабораторные маркеры, по которым врач может установить диагноз, а также для аллергии на пшеницу, а вот для чувствительности к глютену без целиакии ЧГБЦ такого теста нет.
Лечение глютен-зависимых заболеваний связано с соблюдением безглютеновой диеты. Для целиакии это пожизненная диета, для ЧГБЦ и аллергии на пшеницу возможно формирование толерантности с возрастом.
Использованная литература:
- Al-Toma A, Volta U, Auricchio R, et al. European Society for the Study of Coeliac Disease (ESsCD) guideline for coeliac disease and other gluten-related disorders. United European Gastroenterol J. 2019;7(5):583-613. doi:10.1177/2050640619844125Niland B., Cash B.D. Health benefits and adverse effects of a gluten-free diet in non-celiac disease patients. Gastroenterol Hepatol (NY) 2018; 14: 82-91.
- Al-Toma A, Volta U, Auricchio R, et al. European Society for the Study of Coeliac Disease (ESsCD) guideline for coeliac disease and other gluten-related disorders. United European Gastroenterol J. 2019;7(5):583-613. doi:10.1177/2050640619844125
- Golley S., Corsini N., Topping D. et al. Motivations for avoiding wheat consumption in Australia: results from a population survey. Public Health Nutr 2015; 18: 490-499.
- ESPGHAN Guidelines for Diagnosing Coeliac Disease, 2019,2020
- Catassi C, Elli L, Bonaz B, et al. Diagnosis of Non-Celiac Gluten Sensitivity (NCGS): The Salerno Experts’ Criteria. Nutrients. 2015;7(6):4966-4977. doi:10.3390/nu7064966
- Sharma N, Bhatia S, Chunduri V, et al. Pathogenesis of Celiac Disease and Other Gluten Related Disorders in Wheat and Strategies for Mitigating Them. Front Nutr. 2020;7:6. Published 2020 Feb 7. doi:10.3389/fnut.2020.00006 http://www.espghan.org/fileadmin/user_upload/IBD/ESPGHAN_Celiac_Guidelines_2019.pdf
- Lebwohl B., Sanders D.S., Green P.H.R. Coeliac disease. Lancet 2018; 391: 70-81.
- Catassi C., Alaedini A., Bojarski C. et al. The overlapping area of non-celiac gluten sensitivity (NCGS) and wheat-sensitive irritable bowel syndrome (IBS): an update. Nutrients 2017; 9:pii: E1268.
- Tanpowpong P., Ingham T.R., Lampshire P.K. et al. Coeliac disease and gluten avoidance in New Zealand children. Arch Dis Child 2012; 97: 12-16.
- Aziz I., Lewis N.R., Hadjivassiliou M. et al. A UK study assessing the population prevalence of self-reported gluten sensitivity and referral characteristics to secondary care. Eur J Gastroenterol Hepatol 2014; 26: 33-39.
- Carroccio A., Giambalvo O., Blasca F. et al. Self-reported non-celiac wheat sensitivity in high school students: demographic and clinical characteristics. Nutrients 2017; 9: pii: E771.
- Volta U., Tovoli F., Cicola R. et al. Serological tests in gluten sensitivity (nonceliac gluten intolerance). J Clin Gastroenterol 2012; 46: 680-685.
- Carroccio A., Mansueto P., Iacono G. et al. Nonceliac wheat sensitivity diagnosed by double-blind placebo-controlled challenge: exploring a new clinical entity. Am J Gastroenterol 2012; 107: 1898-1906.
- Lovell R.M., Ford A.C. Global prevalence of and risk factors for irritable bowel syndrome: a meta-analysis. Clin Gastroenterol Hepatol 2012; 10: 712-721.
- Carroccio A., Mansueto P., D’Alcamo A., Iacono G. Nonceliac wheat sensitivity as an allergic condition: personal experience and narrative review. Am J Gastroenterol 2013; 108: 1845-1852.
- Hollon J., Puppa E.L., Greenwald B. et al. Effect of gliadin on permeability of intestinal biopsy explants from celiac disease patients and patients with nonceliac gluten sensitivity. Nutrients 2015; 7: 1565-1576.
- Sapone A., Lammers K.M., Casolaro V. et al. Divergence of gut permeability and mucosal immune gene expression in two gluten-associated conditions: celiac disease and gluten sensitivity. BMC Med 2011; 9: 23.
- Portincasa P., Bonfrate L., de Bari O. et al. Irritable bowel syndrome and diet. Gastroenterol Rep (Oxf) 2017; 5: 11-19.
- Vazquez-Roque M.I., Camilleri M., Smyrk T. et al. A controlled trial of gluten-free diet in patients with irritable bowel syndrome-diarrhea: effects on bowel frequency and intestinal function. Gastroenterology 2013; 144: 903.e3-911.e3.
- Wu R.L., Vazquez-Roque M.I., Carlson P. et al. Gluten-induced symptoms in diarrhea-predominant irritable bowel syndrome are associated with increased myosin light chain kinase activity and claudin-15 expression. Lab Invest 2017; 97: 14-23.
- Fritscher-Ravens A., Schuppan D., Ellrichmann M. et al. Confocal endomicroscopy shows food-associated changes in the intestinal mucosa of patients with irritable bowel syndrome. Gastroenterology 2014; 147: 1012.e4-1020.e4.
- Schuppan D., Zevallos V. Wheat amylase trypsin inhibitors as nutritional activators of innate immunity. Dig Dis 2015; 33: 260-263.
- Reig-Otero Y., Manes J., Manyes L. Amylase-trypsin inhibitors in wheat and other cereals as potential activators of the effects of nonceliac gluten sensitivity. J Med Food 2018; 21: 207-214.
- Gomez L., Martin E, Hernandez D. et al. Members of the alpha-amylase inhibitors family from wheat endosperm are major allergens associated with baker’s asthma. FEBS Lett 1990; 261: 85-88.
- Junker Y., Zeissig S., Kim S.J. et al. Wheat amylase trypsin inhibitors drive intestinal inflammation via activation of toll-like receptor 4. J Exp Med 2012; 209: 2395-2408.
- de Punder K., Pruimboom L. The dietary intake of wheat and other cereal grains and their role in inflammation. Nutrients 2013; 5: 771-787.
- Murray K., Wilkinson-Smith V., Hoad C. et al. Differential effects of FODMAPs (fermentable oligo-, di-, mono-saccharides and polyols) on small and large intestinal contents in healthy subjects shown by MRI. Am J Gastroenterol 2014; 109: 110-119.
- Spiller R. How do FODMAPs work? J Gastroenterol Hepatol 2017; 32 Suppl 1: 36-39.
- Catassi C., Elli L., Bonaz B. et al. Diagnosis of non-celiac gluten sensitivity (NCGS): the Salerno Experts’ Criteria. Nutrients 2015; 7: 4966-4977. https://www.vz.kiev.ua/neperenosymist-glyutenu-bez-tseliakiyi-yak-diagnostuvaty-i-likuvaty/
- Непереносимость глютена без целиакии: как диагностировать и лечить?
- ГЛЮТЕН-ЧУВСТВЕННАЯ ЭНТЕРОПАТИЯ: СОСТОЯНИЕ ПРОБЛЕМЫ НА СОВРЕМЕННОМ ЭТАПЕ. Горобец А.А. Национальный медицинский университет имени А.А. Богомольца, г. Киев, https://health-ua.com/article/41194-oberezhnoglyuten--sho-neobhdno-znati-pro-tcelakyu














