Аутоімунні захворювання сполучної тканини: рішення ДІЛА
27.09.2024
Аутоімуні захворювання сполучної тканини (АІЗСТ) – це велика група захворювань з важким перебігом невідомої етіології, які характеризуються генетично зумовленим системним імунозапальним ураженням сполучної тканини і її похідних, що проявляється множинним ураженням органів і тканин та має поліциклічний прогресуючий перебіг. Вони відносяться до гетерогенної групи захворювань і синдромів, що характеризуються однією ознакою — порушенням таких структур, як колаген і еластин.
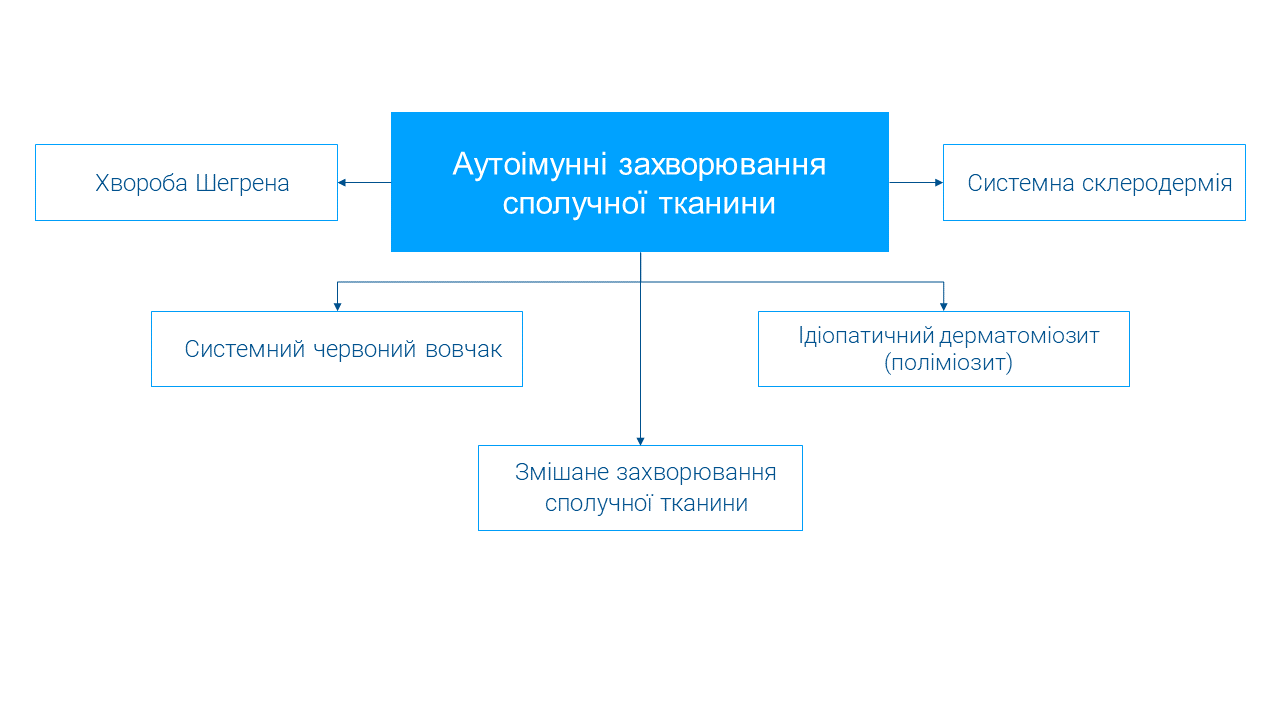
До АІЗСТ відносять:
- хворобу Шегрена (ХШ);
- системний червоний вовчак (СЧВ);
- системну склеродермію (ССД);
- ідіопатичний дерматоміозит/поліміозит (ДМ/ПМ);
- змішане захворювання сполучної тканини (ЗЗСТ).
Чим схожі між собою АІЗСТ
- Відсутність моноетіологічного фактора.
- Спільність патогенезу: імунні й аутоімунні механізми розвитку.
- Спільність патоморфології:
- ураження сполучної тканини;
- фібриноїдний некроз;
- дезорганізація волокнистих структур, зокрема колагенових;
- лімфоїдні і плазмоцитарні інфільтрати.
- Схожість клінічного перебігу: поліциклічний, прогресуючий перебіг; багатосистемність уражень - суглобів, серця, нирок, шкіри, серозних оболонок та ін.
- Схожість лікування: позитивний ефект глюкокортикоїдів, цитостатиків, нестероїдних протизапальних засобів.
- Схожість діагностичних підходів:
- в першу чергу - діагностика всіх АІЗСТ ґрунтується на наявності відповідних клінічних симптомів;
- в подальшому, для верифікації діагнозу, діагностичними біомаркерами є різні аутоантитіла (внаслідок специфічного аутоімунного механізму розвитку даних захворювань). При виявленні антинуклеарних антитіл (ANA), а саме за кількістю та профілем можна більш точно поставити діагноз;
- визначення антинуклеарних антитіл IgG АNА до нуклеарних антигенів при підозрі на АІЗСТ є дослідженням першої лінії з найвищим рівнем доказовості (ІА).
| Аутоімунні захворювання сполучної тканини | Епідеміологія | Клінічні прояви |
| Системний червоний вовчак (СЧВ) - це хронічне аутоімунне захворювання, яке викликає запалення та подальше пошкодження ряду органів, включаючи шкіру, суглоби, нирки, мозок, легені та серце | Системний червоний вовчак є одним з трьох найпоширеніших АІЗСТ, поширеність 100-200 на 100 тис населення. Частіше хворіють жінки (9:1) у віці від 20 до 40 років. |
Лихоманка (≥38,3°С), шкірно-слизові прояви (нерубцева алопеція, виразки у роті, шкірний або дискоїдний червоний вовчак, симптом «метелика»), нейро-психіатричні порушення (делірій, психоз, судоми), полісерозити (плеврит, перикардит), ураження суглобів (синовіїт, набряк, скутість), ураження нирок (люпус-нефрит) |
| Хвороба Шегрена - це аутоімунне системне захворювання сполучної тканини з переважним ураженням залоз зовнішньої секреції (слинних, слізних, вагінальних). | Хвороба Шегрена є одним з трьох найпоширеніших АІЗСТ, поширеність 100-400 на 100 тис населення. На хворобу Шегрена частіше хворіють жінки у віці від 40 до 60 років, також захворювання може зустрічатися у дітей. |
Ксерофтальмія (синдром сухого ока), ксеростомія (синдром сухого рота), сухість шкіри, поява тріщин, припухання дрібних і великих суглобів (як при ревматоїдному артриті, без патологічних змін на рентгенограмах), запалення привушних слинних залоз (паротит), ураження слизової оболонки піхви (сухість, свербіж), сухий кашель, атрофічний гастрит, панкреатит, ураження нирок (гломерулонефрит, інтерстиційний нефрит, СКХ), може розвинутися: псевдолімфома, В-клітинна лімфома або макроглобулінемія Вальденстрема; неходжкінська лімфома розвивається в 40 разів частіше, ніж в загальній популяції. |
| Системна склеродермія (ССД) – системне захворювання сполучної тканини і дрібних судин, що характеризується фіброзно-склеротичними змінами шкіри, кровоносних судин і внутрішніх органів. | Системна склеродермія є одним з трьох найпоширеніших АІЗСТ, поширеність 19-75 на 100 тис населення. Частіше хворіють жінки у віці від 30 до 60 років. | Склероз шкіри пальців обох кистей та проксимальніше п’ястковоо-фалангових суглобів, набряк пальців, склеродактилія, виразкування кінчиків пальців, шрами на кінчиках пальців (т.зв. наперсткові шрами), телеангіектазії, аномалії капілярів нігтьового валика, характерні для склеродермії, артеріальна легенева гіпертензія та/або інтерстиційна хвороба легень, синдром Рейно. |
| Дерматоміозит/поліоміозит (ДМ/ПМ) - важке прогресуюче системне ураження сполучної тканини, гладкої та скелетної мускулатури, шкірних покривів у вигляді еритеми та набряку, судин мікроциркуляторного русла з ураженням внутрішніх органів, насамперед серця, легень і верхнього відділу шлунково-кишкового тракту. | Поширеність 9,63 на 1 млн населення, у жінок діагностується у 2-3 рази частіше, ніж у чоловіків. Може розвиватися в будь-якому віці. Приблизно в третині випадків асоційоване зі злоякісними пухлинами. |
Об’єктивна симетрична м’язова слабкість, зазвичай прогресуюча, проксимальних відділів верхніх та/або нижніх кінцівок; згиначі шиї відносно слабші, ніж розгиначі шиї; у ногах проксимальні м'язи відносно слабші, ніж дистальні; геліотропний висип; папули та/або плями Готтрона, дисфагія або порушення моторики стравоходу. |
| Змішане захворювання сполучної тканини - захворювання, що характеризується накладанням клінічних ознак СЧВ, ССД та ДМ/ПМ, а також високими титрами сироваткових антитіл до рибонуклеопротеїну U1 (U1-RNP). | Поширеність 1,9-3,8 на 100 тис населення. Частіше хворіють жінки у віці від 28 до 48 років. |
Загальні прояви: феномен Рейно, набряклі пальці та/або набряклі руки, ураження органів (легенева артеріальна гіпертензія, асептичний менінгіт, нейропатія трійчастого нерва). Можуть бути накладені (OVERLAP) прояви СЧВ, системної склеродермії, поліміозиту та дерматоміозиту. |
Етапи діагностики АІЗСТ
Лабораторна діагностика АІЗСТ включає в себе два етапи:
І етап – скринінг на наявність антинуклеарних антитіл (ANA скринінг). Позитивний результат скринінгу на антинуклеарні антитіла підтверджує клінічну підозру на АІЗСТ.
NB! Якщо отримано негативний результат скринінгу, ймовірність АІЗСТ у даного пацієнта дуже низька і цей діагноз малоймовірний, а подальше обстеження на АІЗСТ є недоцільним.
NB! Наявність сироваткових ANA без клінічних симптомів не підтверджує діагноз АІЗСТ.
ІІ етап – специфічна діагностика, необхідна для верифікації діагнозу того чи іншого АІЗСТ згідно сучасних рекомендацій. Рекомендовано подальше кількісне визначення окремих сироваткових антинуклеарних антитіл для визначення позитивності відповідно до захворювання, яке підозрюється.
Остаточна інтерпретація результату серологічних досліджень повинна враховувати результати всіх часткових досліджень (наприклад кілька типів ANA, включених у класифікаційні критерії, результати скринінгового і підтверджуючого тесту), які повинні відповідати один одному і клінічній картині.
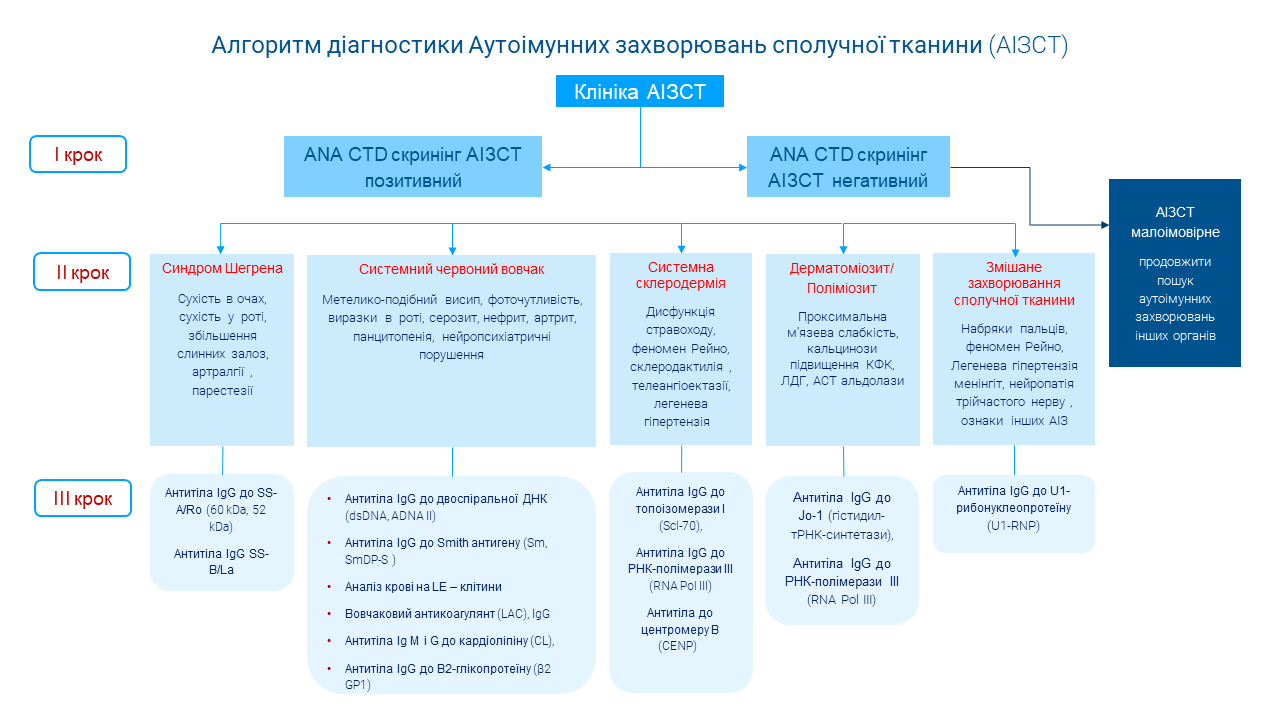
Умовні скорочення:
АІЗСТ – аутоімунні захворювання сполучної тканини
ХШ – хвороба Шегрена
СЧВ – системний червоний вовчак
ССД – системна склеродермія
ДМ/ПМ – дерматоміозит/поліміозит
ЗЗСТ – змішане захворювання сполучної тканини
| Етапи діагностики | Нозологія | Міжнародні рекомендації | Продукт ДІЛА ДН Системні захворювання сполучної тканини |
| І етап - скринінг АІЗСТ | Аутоімунні захворювання сполучної тканини | ANA | «Антинуклеарні антитіла IgG (ANA, CTD скринінг), ELIA Phadia» |
| ІІ етап- специфічна діагностика АІЗ СТ | Системний червоний вовчак | ANA, dsDNA, Sm, Anticardiolipin IgG, anti-β2-glycoprotein 1 antibodies, ВА, Lupus anticoagulants | Антитіла IgG до двоспіральної (нативної) ДНК (dsDNA, ADNA II), кількісний |
| Антитіла IgG до кардіоліпіну (CL), кількісний | |||
| Антитіла IgM до кардіоліпіну (CL), кількісний | |||
| Вовчаковий антикоагулянт (LАC), антитіла IgG, кількісний | |||
| Антитіла IgG до В2-глікопротеїну (β2 GP1), кількісний | |||
| Антитіла IgM до В2-глікопротеїну (β2 GP1), кількісний | |||
| Антитіла IgG до Smith (Sm, SmDP-S антигену), кількісний | |||
| Аналіз крові на LE - клітини | |||
| Системна склеродермія | Anti-centromere, Anti-topoisomerase-1(anti-scl 70), Anti-RNA polymerase III | Антитіла IgG до топоізомерази I (Scl-70), кількісний | |
| Антитіла до центромеру В (CENP) IgG, кількісний | |||
| Антитіла IgG до односпіральної ДНК (ssDNA, ADNA I), кількісний | |||
| Антитіла IgG до РНК-полімерази ІІІ (RNA Pol III), кількісний | |||
| Дерматоміозит\поліміозит | Jo-1 | Антитіла IgG до РНК-полімерази ІІІ (RNA Pol III), кількісний | |
| Антитіла IgG до Jo-1 (гістидил-тРНК-синтетази), кількісний | |||
| Хвороба Шегрена | Ro | Антитіла IgG до SS-A/Ro (60 kDa, 52 kDa), кількісний | |
| Антитіла IgG до SS-A/Ro (60 kDa, 52 kDa) та SS-B/La, кількісний | |||
| Змішане захворювання сполучної тканини | U1 | Антитіла IgG до U1-рибонуклеопротеїну (U1-RNP), кількісний |
Переваги дослідження Антинуклеарні антитіла IgG (ANA, CTD скринінг), ELIA Phadia
Скринінговий тест на ANA Антинуклеарні антитіла IgG (ANA, CTD скринінг), ELIA Phadia https://dila.ua/program/3587_antynuklearni-antytila----skryninh--.html – містить багато антигенів, є повністю автоматизованим, що збільшує чутливість та специфічність тестування на ANA для оптимальної діагностики АІЗСТ.
Дослідження Антинуклеарні антитіла IgG (ANA, CTD скринінг), ELIA Phadia https://dila.ua/program/3587_antynuklearni-antytila----skryninh--.html виявляє сироваткові антинуклеарні антитіла IgG до до суміші з 14 розчинних нуклеарних антигенів:
- U1-RNP
- SS-A/Ro
- SS-B/La
- centromere B
- Scl-70
- Jo-1
- Fibrillarin
- RNA Pol III
- Rib-P
- PM-Scl
- PCNA
- Mi-2
- Sm
- dsDNA.
Якщо у пацієнта визначаються позитивні ANA методом ІФА, це свідчить лише про наявність аутоімунного захворювання (аутоімунний тиреоїдит, аутоімунний гепатит, ревматоїдний артрит, АІЗСТ, тощо), а високоспецифічний CTD-скринінг спростовує або підтверджує підозру саме на АІЗСТ.
Тобто ANA CTD скринінг дає змогу одразу звузити діагностичний пошук до системних захворювань сполучної тканини. Дослідження виконується автоматизованим імунофлюороферментним методом, тому має високу чутливість 92% та специфічність 84%, що дозволяє максимально зменшити кількість хибнопозитивних та хибнонегативних результатів і має значно більшу специфічність та чутливість, ніж визначення ANA методом ІФА.
Позитивний результат ANA скринінгу підтверджує клінічну підозру на АІЗСТ. Рекомендовано подальше кількісне визначення окремих сироваткових антинуклеарних антитіл для визначення позитивності відповідно до захворювання, яке підозрюється.
Визначення антинуклеарних антитіл IgG АНА до нуклеарних антигенів при підозрі на СЗСТ є дослідженням першої лінії (2019 EULAR/ACR classification criteria for SLE; 2016 ACR/EULAR classification criteria for primary Sjogren’s syndrome; 2013 Classification criteria for systemic sclerosis: an ACR/EULAR collaborative initiative; 2017 EULAR/ACR classification criteria for adult and juvenal idiopathy myopathies and their major subgroups this inflammatory, 2019 Diagnostic criteria for mixed connective tissue disease (MCTD): from the Japan research committee of the ministry of health).
Якщо отримано негативний результат скринінгу, ймовірність АІЗСТ у даного пацієнта дуже низька і цей діагноз малоймовірний, а подальше обстеження на АІЗСТ є недоцільним, рекомендовано продовжити діагностичний пошук аутоімунних захворювань інших органів.
Переваги портфелю Діагностики АІЗСТ від ДІЛА
- Портфель АІЗСТ від ДІЛА відповідає міжнародним рекомендаціям та галузевим стандартам МОЗ України
- Перший етап представлено дослідженням Антинуклеарні антитіла IgG (ANA, CTD скринінг), ELIA Phadia, який має наступні переваги:
- Найточніший ANA CTD -скринінг виконаний автоматизованим імунофлюороферментним методом, що максимально мінімалізує імовірність похибки (”людський” фактор при ручному підрахунку збільшує імовірність похибки);
- ANA CTD -скринінг виявляє як сироваткові антинуклеарні антитіла IgG та екстраговані ядерні антитіла (ENA) до найвагоміших нуклеарних антигенів (U1-RNP, SS-A/Ro, SS-B/La, centromere B, Scl-70, Jo-1, fibrillarin, RNA Pol III, Rib-P, PM-Scl, PCNA, Mi-2, Sm, dsDNA);
- ANA CTD -скринінг є остаточним скринінговим тестом, при позитивному результаті якого додаткові підтверджуючі тести на першому етапі лабораторної діагностики уже не проводяться, а відразу виконуються тести другого етапу специфічної діагностики.
- Другий етап діагностики представлено автоматизованими методами ІФА ELIA, мають найвищу специфічність та чутливість на ринку, проходять щомісячне зовнішнє оцінювання в референтній європейській лабораторії, що забезпечить достовірність діагностики та правильність постановки діагнозу АІЗ СТ.
- Результати досліджень визнані у будь-якій країні світу, оскільки ДІЛА має міжнародну акредитацію ISO 15189.
- При необхідності проведення додаткових досліджень можна використати банк біологічного матеріалу (БМ) ДІЛА (БМ зберігається 30 днів від моменту забору).
- Відділення ДІЛА працюють на генераторах, а отже ви завжди отримаєте свої результати вчасно, адже ДІЛА працює згідно графіку.
Джерела:
- Md Yusof MY, Smith EMD, Ainsworth S, et al. Management and treatment of children, young people and adults with systemic lupus erythematosus: British Society for Rheumatology guideline scope. Rheumatol Adv Pract. 2023 Dec 5;7(3):rkad093. doi: 10.1093/rap/rkad093. PMID: 38058676; PMCID: PMC10695902. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10695902/
- Price EJ, Benjamin S, Bombardieri M, et al. British Society for Rheumatology guideline on management of adult and juvenile onset Sjögren disease. Rheumatology (Oxford). 2024 Apr 16:keae152. doi: 10.1093/rheumatology/keae152. Epub ahead of print. PMID: 38621708. https://pubmed.ncbi.nlm.nih.gov/38621708/
- Elizabeth J Price, Stuart Benjamin, Michele Bombardieri, et al. British Society for Rheumatology guideline on management of adult and juvenile onset Sjögren disease, Rheumatology, 2024;, keae152, https://doi.org/10.1093/rheumatology/keae152
- Ramos-Casals M, Brito-Zerón P, Bombardieri S, et al. EULAR-Sjögren Syndrome Task Force Group. EULAR recommendations for the management of Sjögren's syndrome with topical and systemic therapies. Ann Rheum Dis. 2020 Jan;79(1):3-18. doi: 10.1136/annrheumdis-2019-216114. Epub 2019 Oct 31. PMID: 31672775. https://pubmed.ncbi.nlm.nih.gov/31672775/
- Devauchelle-Pensec V, Mariette X, Benyoussef AA, Boisrame S, Cochener B, Cornec D, Nocturne G, Gottenberg JE, Hachulla E, Labalette P, Le Guern V, M'Bwang Seppoh R, Morel J, Orliaguet M, Saraux A, Seror R, Costedoat-Chalumeau N; Collaborators. French national diagnostic and care protocol for Sjögren's disease. Rev Med Interne. 2023 Aug;44(8):423-457. doi: 10.1016/j.revmed.2023.07.001. Epub 2023 Jul 13. PMID: 37453854. https://pubmed.ncbi.nlm.nih.gov/37453854/
- Maleki-Fischbach M, Kastsianok L, Koslow M, Chan ED. Manifestations and management of Sjögren's disease. Arthritis Res Ther. 2024 Feb 8;26(1):43. doi: 10.1186/s13075-024-03262-4. PMID: 38331820; PMCID: PMC10851604. https://pubmed.ncbi.nlm.nih.gov/38331820/
- Trevisani VFM, Pugliesi A, Pasoto SG, et al. Recommendations for evaluation and diagnosis of extra-glandular manifestations of primary sjogren syndrome: results of an epidemiologic systematic review/meta-analysis and a consensus guideline from the Brazilian Society of Rheumatology (articular, pulmonary and renal). Adv Rheumatol. 2022 Jun 1;62(1):18. doi: 10.1186/s42358-022-00248-1. PMID: 35650656. https://pubmed.ncbi.nlm.nih.gov/35650656/
- Price E, Allen A, Rauz S et al. The management of Sjogren’s syndrome: British Society for Rheumatology guideline scope. Rheumatology 2020;60:2122–7. https://pubmed.ncbi.nlm.nih.gov/33331922/
- Omma A, Tecer D, Kucuksahin O et al. Do the European League Against Rheumatism (EULAR) Sjogren's syndrome outcome measures correlate with impaired quality of life, fatigue, anxiety and depression in primary Sjogren's syndrome? Arch Med Sci 2018;14:830–7. https://pubmed.ncbi.nlm.nih.gov/30002701/
- Vivino FB, Carsons SE, Foulks G, et al. New Treatment Guidelines for Sjögren's Disease. Rheum Dis Clin North Am. 2016 Aug;42(3):531-51. doi: 10.1016/j.rdc.2016.03.010. PMID: 27431353; PMCID: PMC5812283. https://pubmed.ncbi.nlm.nih.gov/27431353/
- Cassard L, Seraly N, Riegert M, Patel A, Fernandez AP. Dermatomyositis: Practical Guidance and Unmet Needs. Immunotargets Ther. 2024 Mar 6;13:151-172. doi: 10.2147/ITT.S381472. PMID: 38464459; PMCID: PMC10924937. https://pubmed.ncbi.nlm.nih.gov/38464459/
- Lu Q, Long H, Chow S, et al. Guideline for the diagnosis, treatment and long-term management of cutaneous lupus erythematosus. J Autoimmun. 2021 Sep;123:102707. doi: 10.1016/j.jaut.2021.102707. Epub 2021 Aug 5. PMID: 34364171. https://pubmed.ncbi.nlm.nih.gov/34364171/
- Sapkota B, Al Khalili Y. Mixed Connective Tissue Disease. [Updated 2023 Apr 3]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK542198/
- Alarcón-Segovia D, Cardiel MH. Comparison between 3 diagnostic criteria for mixed connective tissue disease. Study of 593 patients. J Rheumatol. 1989 Mar;16(3):328-34. https://pubmed.ncbi.nlm.nih.gov/2724251/
- Tanaka Y, Kuwana M, Fujii T, et al. 2019 Diagnostic criteria for mixed connective tissue disease (MCTD): From the Japan research committee of the ministry of health, labor, and welfare for systemic autoimmune diseases. Mod Rheumatol. 2021 Jan;31(1):29-33. doi: 10.1080/14397595.2019.1709944. Epub 2020 Jan 7. PMID: 31903831. https://pubmed.ncbi.nlm.nih.gov/31903831/
- Volkmann ER, Andréasson K, Smith V. Systemic sclerosis. Lancet. 2023 Jan 28;401(10373):304-318. doi: 10.1016/S0140-6736(22)01692-0. Epub 2022 Nov 25. PMID: 36442487; PMCID: PMC9892343. https://pubmed.ncbi.nlm.nih.gov/36442487/
- van den Hoogen F, Khanna D, Fransen J, et al. 2013 classification criteria for systemic sclerosis: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Ann Rheum Dis 2013; 72: 1747–55. https://pubmed.ncbi.nlm.nih.gov/24092682/
- Morrisroe K, Stevens W, Sahhar J, et al. The clinical and economic burden of systemic sclerosis related interstitial lung disease. Rheumatology (Oxford) 2020; 59: 1878–88. https://pubmed.ncbi.nlm.nih.gov/31740961/
- Smith V, Scire CA, Talarico R, et al. Systemic sclerosis: state of the art on clinical practice guidelines. RMD Open 2018; 4: e000782. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6203100/
- Lundberg IE, Tjärnlund A, Bottai M, et al. 2017 European League Against Rheumatism/American College of Rheumatology classification criteria for adult and juvenile idiopathic inflammatory myopathies and their major subgroups [published correction appears in Ann Rheum Dis. 2018 Sep;77(9):e64]. Ann Rheum Dis. 2017;76(12):1955-1964. doi:10.1136/annrheumdis-2017-211468. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5846474/
| Станьте партнером ДІЛА Вигідна співпраця та професійний розвиток |
Доєднатись |
| Особистий кабінет лікаря Управління профілем та результатами досліджень |
Доєднатись |
| Медична спільнота ДІЛА Обмін досвідом та актуальні медичні новини |
Доєднатись |
*У разі виникнення питань просимо звертатись на гарячу лінію: 0 800 217 887
7:00 - 20:00