Общий вариабельный иммунодефицит: причины, дебют, клинические проявления, диагностика и лечение
09.02.2023
Общий вариабельный иммунодефицит (ОВД, Common variable immunodeficiency, CVID) – группа первичных иммунных расстройств, относящихся к врожденным ошибкам иммунитета с различными механизмами развития, характеризующаяся критически низким уровнем продукции антител и, соответственно, нарушением иммунной защиты. Термин "общий" является переводом английского слова "common", которое на самом деле означает "частый". ОВИ действительно относится к наиболее распространенным тяжелым первичным иммунодефицитам. Слова «вариабельный» отражает многообразие клинической манифестации. ОВИ является хроническим неизлечимым заболеванием продолжительностью в жизни, но эффективные средства поддерживающей терапии позволяют лицам с ОВИ вести почти нормальную продуктивную жизнь. Именно поэтому своевременное распознавание симптомов и правильная диагностика чрезвычайно важны для спасения жизни пациентов и обеспечения его высокого качества.
Частота заболевания оценивается как 1 на 25-50 тысяч населения. ОВИ относится к врожденным иммунодефицитам с типичным дебютом во взрослом возрасте. Заболевание также известно как гипогаммаглобулинемия, агаммаглобулинемия взрослого возраста, гипогаммаглобулинемия с поздним началом, приобретенная агаммаглобулинемия. Несмотря на то, что диагноз обычно приходится на возраст 20-50 лет (согласно исследованию Европейского реестра иммунодефицитов средний возраст появления симптомов – 26,3 года), первые признаки могут появиться в детском или подростковом возрасте, часто остаются нераспознанными. Женщины и мужчины болеют одинаково часто.
Причины
Большинство случаев являются спорадическими и возникают у людей без отягощенного семейного анамнеза. Наиболее вероятно, заболевание является результатом взаимодействия поломок в генах, отвечающих за развитие и функционирование иммунной системы и внешних факторов. Генетическую природу ОВИ удается установить только в 10-15% случаев. Мутации, по меньшей мере, в 13 генах были ассоциированы с развитием общего вариабельного иммунодефицита: TNFRSF13В, CD19, CD81, CR2, ICOS, IKZF1, IL21, LRBA, MS4A1, NFKB1, N
Наиболее часто идентифицированы мутации в гене TNFRSF13B, часто эти мутации являются спорадическими, возникающие во время созревания половых клеток или в раннем эмбриональном периоде. Мутации в гене TNFRSF13B могут наследоваться как по аутосомно-рецессивному, так и по аутосомно-доминантному типу. Белок, являющийся результатом работы данного гена, играет роль в выживании и созревании В-лимфоцитов и в продукции антител. Другие гены, ассоциированные с ОВИ, также вовлечены в функционирование и/или созревание иммунных клеток. У многих пациентов с ОВИ обнаруживают полиморфизм в гене TACI. Тем не менее эта генетическая аномалия лишь подтверждает риск развития ОВИ, но сама по себе не является его единственной причиной, поскольку не у всех членов семьи с одинаковой мутацией развивается заболевание. Дополнительные неидентифицированные на сегодняшний день триггеры, очевидно, необходимы для начала заболевания. Дальнейшие исследования для идентификации молекулярно-генетических причин развития ОВИ на сегодняшний день активно продолжаются, ежегодно приводя к открытию новых мутаций и генов.
Таким образом, ОВИ – это гетерогенная группа иммунодефицитных состояний с различными механизмами наследования, пусковыми факторами и генетическими поломками, лежащими в их основе.
Тем не менее общими для них являются нарушения антителопродукции. У всех лиц с общим вариабельным иммунодефицитом наблюдается значительное снижение продукции не менее двух классов иммуноглобулинов (IgG и IgA) или более. У половины пациентов наблюдается почти нулевой уровень продукции иммуноглобулина М и других классов. Достоверно, что иммунологические нарушения развиваются постепенно. Считают, что ОВИ связан с селективным дефицитом иммуноглобулина А. В большинстве случаев селективный дефицит иммуноглобулина А является самостоятельным заболеванием, изолированное нарушение выработки иммуноглобулина А может предшествовать развитию развернутой картины ОВИ, что подтверждается наличием случаев существования в одной семье лиц с селем и ОВИ.
Клинические проявления
Разнообразие первых клинических проявлений и их тяжесть существенно варьируют у разных пациентов.
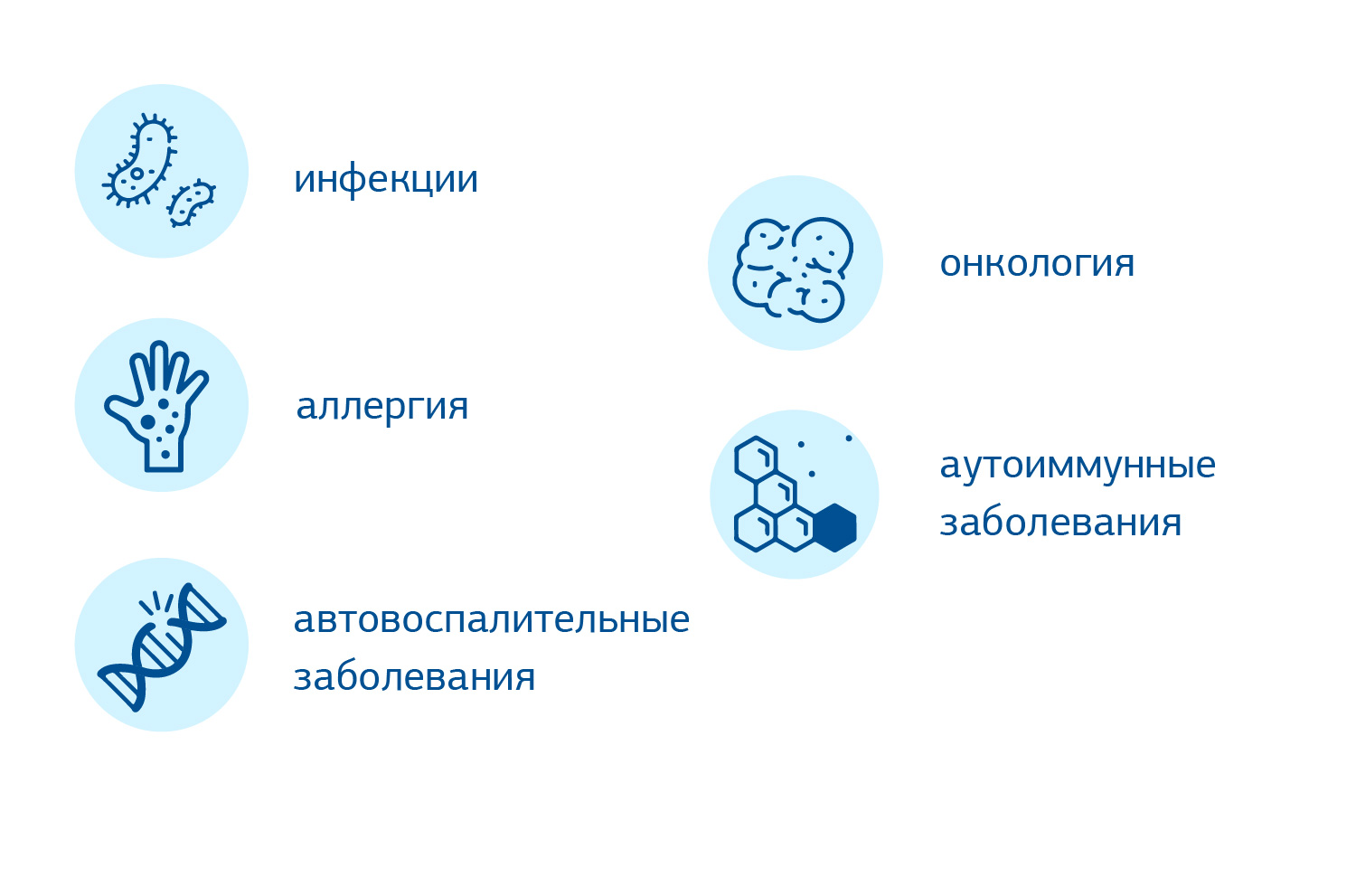
Основным клиническим следствием гипогаммаглобулинемии является развитие рецидивных бактериальных инфекций. К дополнительным нарушениям при ОВИ относятся повышенный риск развития аутоиммунных, автовоспалительных, аллергических, гастроинтестинальных, лимфопролиферативных и онкологических заболеваний.
Инфекции являются прямым следствием низкого (в ряде случаев – близкого к нулевому) уровня циркулирующих антител, не способных защитить против микробных агентов. Наиболее частыми микробами, вызывающими заболевания у пациентов с ОВИ, являются Haemophilus influenzae, Streptococcus pneumoniae и Staphylococcus aureus, реже – Neisseria meningitidis, Pseudomonas aeruginosa и Giardia lamblia. Наиболее частыми проявлениями являются инфекции дыхательных путей (носоглотка, приносовые пазухи, бронхи, легкие) и уши, но фактически могут охватывать любые органы, включая кожу и подкожную клетчатку, желудочно-кишечный тракт. Обычно инфекции хорошо отвечают на лечение антибиотиками, однако быстро рецидивируют после их отмены. Непрерывно рецидивирующие бронхо-легочные инфекции могут вызвать перманетное повреждение бронхов – бронхоэктазы.
Пациенты с ОВИ также находятся в риске развития вакцин-контролируемых инфекций, таких как корь, грипп, дифтерия, столбняк и другие, поскольку иммунная защита от ранее полученных прививок теряется.
Нарушения защитных механизмов оказывают негативное влияние не только на контроль над инфекциями, но и на механизмы иммунологической толерантности. От 20 до 50% пациентов со ОВИ имеют аутоиммунные расстройства, такие как аутоиммунные цитопении (гемолитическая анемия, тромбоцитопения, аутоиммунная нейтропения), ревматоидный артрит, ЮИА, васкулит, СКВ, гломерулонефрит, аутоиммунный тиреоидит, сахарный диабет 1 типа, болезнь Аддисона или гипопаратиреоидизм), псориаз, алопеция, витилиго. Наиболее часто аутоиммунным атакам подвергаются клетки крови, из которых тромбоцитопения занимает первое место и нередко является первой манифестацией этого заболевания еще до развития инфекционного синдрома. Аутоантитела, первичная или вторичная дисфункция костного мозга (КМ), клеточный аутоиммунитет и дизрегуляция иммунной системы являются основными причинами этих проявлений. В то же время, как и в случае патологической предрасположенности к инфекционным заболеваниям чаще подозревают врожденный иммунодефицит, проверка пациентов с аутоиммунными заболеваниями не является частой практикой, задерживающей путь к правильному диагнозу.
Типичными для пациентов с ОВИ являются хроническая диарея, синдром мальабсорбции и потеря массы тела. Устойчивое к лечению течение хронической диареи может быть важным указанием на наличие иммунодефицита. Симптомы энтеропатии при ОВИ могут быть следствием как инфекций (например, персистенции Giardia lamblia, кампилобактериями, ЦМВ или сальмонелл), так и воспалительного заболевания кишечника, требующего проведения дифференциальной диагностики между ними.
Из-за нарушения развития В-лимфоцитов возможна аккумуляция их в лимфоидных тканях с развитием лимфопролиферативного синдрома: увеличение лимфатических узлов, гепато- и спленомегалия, формированием гранулем в различных органах (образование третичной лимфатической ткани, в частности в легких). Helen Chapel с соавторами (2008) в своей группе 334 пациентов с ЗВИД из 7 европейских центров выявили признаки лимфопролиферации у 54% больных.
У многих пациентов с общим вариабельным иммунодефицитом имеют в анамнезе симптомы, похожие на аллергию. В то же время симптомы рецидивирующих респираторных инфекций могут быть спутаны с аллергией, выступать их маской. По данным литературы, астма и аллергический ринит встречаются у 37,5% и 55,5% пациентов со ОВИ соответственно. Тем не менее поскольку аллергия является очень распространенным заболеванием, особенно в детском возрасте, и эти показатели постоянно растут во всем мире, такое проявление показательно преимущественно только в комбинации с другими, более специфическими проявлениями.
Длительное нарушение функции иммунитета с течением времени приводит к повышенному риску онкологических заболеваний. В случае с ОВИ особенно склонность к развитию лимфом и раку желудка, риск развития данных видов рака в 50 раз превышает риск в общей популяции. Иногда заболевание может манифестировать с лимфомой.
Иммунологическая характеристика
У пациентов с ОВИ наблюдается разнообразие иммунологических фенотипов. В частности, широко варьируют уровни сывороточных иммуноглобулинов. Пациенты могут быть сгруппированы в следующие три категории: отсутствует продукция иммуноглобулинов; частично сохраненная продукция иммуноглобулинов; сохранена продукция только иммуноглобулина М.
Количество В-лимфоцитов также значительно варьирует у разных пациентов. У около 12% пациентов B-лимфоцитов полностью отсутствуют, но 54% имеют уровень B-лимфоцитов в пределах референтных значений. Особенностью ОВИ является снижение процента В-клеток памяти. Также может отмечаться нарушение относительного и абсолютного количества других субпопуляций В-лимфоцитов. У некоторых пациентов отмечается также вариабельное нарушение Т-клеточного звена, в частности часто отмечается низкое содержание CD4+ и Т-регуляторных клеток. Около 10% могут иметь уровень CD4+ T-клеток на уровне ниже 200 клеток/мм3; такой фенотип еще называют «комбинированный иммунодефицит с поздним началом», этот вид заболевания имеет худший прогноз, чем классический ОВИ.
Диагностика
Из-за того, что в большинстве случаев генетический дефект установить не удается, на сегодняшний день диагноз общего вариабельного иммунодефицита базируется на клинико-лабораторных критериях. Для установления клинического диагноза без генетического диагноза Европейским обществом иммунодефицитов (ESID) разработаны рабочие диагностические критерии.
Рабочие диагностические критерии ESID-2019:
по крайней мере, одно из следующего:
- повышенная восприимчивость к инфекции
- аутоиммунные проявления
- гранулематозная болезнь
- поликлональная лимфопролиферация неясного генеза
- семейный анамнез дефицита антителообразования
И - снижение IgG (<4,5 г/л) и существенное снижение уровня IgA с или без снижения IgM (измеренные по меньшей мере дважды; <2SD от нормального уровня для их возраста)
И
по крайней мере, одно из следующего:
- пониженная продукция антител на вакцины и/или отсутствующие изогемагглютинины;
- сниженные В-клетки памяти
И - вторичные причины гипогамаглобулинемии исключены.
Общий вариабельный иммунодефицит устанавливается у лиц старше 4 лет согласно перечисленным критериям, если альтернативные причины гипогаммаглобулинемии, такие вторичные гипогаммаглобулинемии и другие известные первичные иммунодефициты исключены.
Лечение
Основой лечения ОВИ является заместительная терапия иммуноглобулинами. Регулярное введение иммуноглобулинов внутривенным (1 раз в 4 недели) или подкожным (1-3 раза в неделю) путем в большинстве случаев компенсирует дефект антителообразования и позволяет вести больным практически нормальную жизнь. Иногда начало заместительной терапии значительно облегчает течение даже неинфекционных осложнений, таких как артриты, поражения кожи, аллергические проявления. У пациентов с частично сохраненной функцией антителопродукции может применяться дополнительная вакцинация против пневмококковой и менингококковой инфекции и гриппа. При наличии хронических очагов бактериального воспаления, особенно у пациентов со сформированными бронхоэктазами, в дополнение к заместительной терапии назначается длительная антибиотикопрофилактика. Лечение других осложнений, таких как поражение желудочно-кишечного тракта, аутоиммунные, аллергические или онкологические заболевания при возникновении осуществляется согласно протоколам лечения данных заболеваний.
Клинический пример:
Мужчина 36 лет обратился по поводу непрерывно рецидивирующего гнойного синусита и частых эпиходов гнойного отита за последние два года, что привело к частичной потере слуха. В анамнезе – перенесенная в возрасте 33 лет неходжкинская В-клеточная лимфома, по поводу которой пациент получал ритуксимаб. На фоне лечения была обнаружена гипогаммаглобулинемия (IgA 0,15 г/л, IgM 2,5 г/л, IgG 1,8 г/ л), расцененная как побочный эффект терапии. На момент обращения через 3,5 года ремиссии и отмены ритуксимаба у пациентов определяются нормальные уровни всех субпопуляций лимфоцитов, включая В-лимфоциты и уровни всех иммуноглобулинов – ниже предела определения.
Продолжительное время, прошедшее после отмены ритуксимаба, равно как и нормальное количество общих В-лимфоцитов, восстановившихся после применения моноклональных антител против них, делает сомнительной трактовку гипогаммаглобулинемии как следствия терапии ритуксимабом.
При подозрении на общий варибаэльный иммунодефицит, манифестировавший с лимфомы для проверки соответствия критериям были проведены дополнительные обследования:
Изогемагглютинины α, β (естественные антитела по системе ABO)
– позволяет оценить способность к спонтанной продукции природных иммуноглобулинов класса М и способности к продукции антител против полисахаридных антигенов (один из необходимых критериев)
В-клеточное звено (В1-, В2-, В-клетки памяти)
– позволяет оценить уровень В-клеток памяти (один из необходимых критериев).
По результатам обследования:
при группе крови А(II) у пациента бета-изогемагглютинины не обнаружены (референтные значения 1:8-1:128)
В клетки памяти – 6,09% (референтные значения 22-40%).
Таким образом, клинико-лабораторные критерии дают право установить диагноз общего вариабельного иммунодефицита.
В этом случае лимфома могла развиться на фоне уже нарушенного иммунитета как первое его проявление (отсутствие данных предварительного иммунологического обследования делает невозможным установление причинно-следственной связи) или, возможно, лимфома или ее причина выступила в качестве триггера запуска генетического дефекта у предрасположенного к этому пациенту.
Данный случай демонстрирует сложность иногда дифференциальной диагностики между первичным и вторичным иммунодефицитом, поэтому полезно было бы иметь информацию об исходном уровне иммунологических показателей перед назначением иммуносупрессивной терапии путем иммунологического обследования (субпопуляции лимфоцитов и иммуноглобулины A, M, G). Также является иллюстративным, поскольку демонстрирует длительное восстановление после иммуносупрессивной терапии и повод подозревать первичный иммунодефицит с поздним стартом, которым является общий вариабельный иммунодефицит.
Источники:
- ПЕРВИЧНЫЕ ИММУНОДЕФИЦИТЫ КЛИНИЧЕСКОЕ УЧРЕЖДЕНИЕ, ОСНОВАННОЕ НА ДОКАЗАТЕЛЬСТВАХ (2021) https://www.dec.gov.ua/wp-content/uploads/2022/01/2021_11_01_kn-pid.pdf
- Приказ Минздрава № 2952 от 31.12.2021 Об утверждении Стандартов медицинской помощи "Диагностика и лечение первичных иммунодефицитов"
- Robert A Schwartz. Common Variable Immunodeficiency. https://emedicine.medscape.com/article/1051103-overview Updated: Jun 08, 2022
- Bonilla, Francisco A.; Geha, Raif S. (2009). "Common Variable Immunodeficiency". Pediatric Research. 65 (5): 13R–19R. doi:10.1203/pdr.0b013e31819dbf88. PMID 19190529. S2CID 9361175.
- Kienzler AK, Hargreaves CE, Patel SY. The role of genomics in common variable immunodeficiency disorders. Clin Exp Immunol. 2017 Feb 25. [QxMD MEDLINE Link].
- Christiansen M, Offersen R, Jensen JMB, Petersen MS, Larsen CS, Mogensen TH. Identification of Novel Genetic Variants in CVID Patients With Autoimmunity, Autoinflammation, or Malignancy. Front Immunol. 2019. 10:3022.
- Agondi RC, Barros MT, Kokron CM, Cohon A, Oliveira AK, Kalil J, Giavina-Bianchi P. Can patients with common variable immunodeficiency have allergic rhinitis? Am J Rhinol Allergy. 2013 Mar-Apr;27(2):79-83. doi: 10.2500/ajra.2013.27.3855. PMID: 23562193.
- Schwartz, Robert A; Modak, Rohit; Modak, Prema. "Common Variable Immunodeficiency Treatment and Management". Medscape. Retrieved 17 February 2016.
- Робочі діагностичні критерії ESID-2019 https://esid.org/Working-Parties/Registry-Working-Party/Diagnosis-criteria